5.2
?
下列说法中正确的是
A.向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c( )>c( )>c(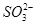 )>c(OH-) )>c(OH-)
参考答案:A
本题解析:依据Cl2+H2O H++Cl-+HClO结合NaHCO3只与H+反应可知A选项正确;水解程度最大的是Na2CO3,B选项错误;相同浓度时,H2SO3的pH最小,C选项错误;c( H++Cl-+HClO结合NaHCO3只与H+反应可知A选项正确;水解程度最大的是Na2CO3,B选项错误;相同浓度时,H2SO3的pH最小,C选项错误;c( 本题难度:一般 本题难度:一般
2、选择题 向1L 0.3mol/L的NaOH溶液中通入标准状况下CO2 4.48L,下列关系不正确的是
A.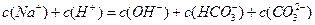
B.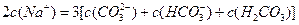
C.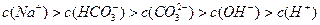
D.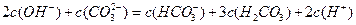
参考答案:A
本题解析:略
本题难度:一般
3、选择题 下列关于各溶液的描述中正确的是?????????? ( )。
A.pH相等的①NH4Cl,②(NH4)2SO4,③NH4HSO4的溶液中,c(NH4+)大小:①=②=③
B.常温下,在10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20 mL
C.向1.00 L 0.3 mol·L-1的NaOH溶液中缓慢通入CO2气体至溶液增重8.8 g,所得溶液中:3c(Na+)=2[c(HCO3—)+c(CO32—)+c(H2CO3)]
D.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-)
参考答案:B
本题解析:NH4Cl,(NH4)2SO4溶液中NH4+水解使溶液呈酸性:NH4++H2O NH3·H2O+H+,但水解是微弱的,NH4HSO4=NH4++H++SO42—,H+全部电离,溶液呈酸性,故c(NH)相同的NH4Cl,(NH4)2SO4,NH4HSO4三溶液中,c(H+)大小:①=②<③,现三溶液pH相同, NH3·H2O+H+,但水解是微弱的,NH4HSO4=NH4++H++SO42—,H+全部电离,溶液呈酸性,故c(NH)相同的NH4Cl,(NH4)2SO4,NH4HSO4三溶液中,c(H+)大小:①=②<③,现三溶液pH相同,
本题难度:一般
4、选择题 下列有关物质浓度关系的描述中,正确的是
A.25℃时,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42—)>c(OH—)=c(H+)
B.25℃时,NaB溶液的pH=8,c(Na+) + c(B-)=9.9×10-7mol·L-1
C.0.1mol·L-1的NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
D.同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3)
参考答案:C
本题解析:
试题分析:A.25℃时,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性时违背溶液呈电中性原理。应该为c(Na+)>c(SO42—)>c(NH4+)>c(OH—)=c(H+)。错误。B. 在溶液中存在水解平衡:B-+H2O  ?HB+OH-。pH=8,c(H+)=10-8mol/Lc(OH ?HB+OH-。pH=8,c(H+)=10-8mol/Lc(OH
本题难度:一般
5、选择题 25℃时,下列各溶液(均为0.1 mol·L-1)中,离子(或分子)的物质的量浓度关系正确的是
A.氯化铵溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.碳酸钠溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol·L-1
C.醋酸钠溶液中:c(OH-)>c(H+)+c(CH3COOH)
D.碳酸氢钠溶液中:c(Na+)-c(OH-)=c(HCO3-)+c(CO32-)-c(H+)
参考答案:B
本题解析:
试题分析:A、氯化铵溶于水水解溶液显酸性,则c(Cl-)>c(NH4+)>c(H+) >c(OH-),A不正确;B、根据物料守恒可知碳酸钠溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol·L-1,B正确;C、醋酸钠溶液中根据质子守恒可知c(OH-)=c(H+)+c(CH3COOH),C不正确;D、根据电荷守恒可知碳酸氢钠溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+ c(OH-),D不正确,答案选B。
本题难度:一般
|  )>c(
)>c(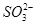 )>c(OH-)
)>c(OH-)