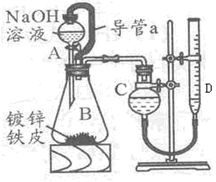
?
?

参考答案:(1)分液漏斗,锥形瓶
(2)将AB连通,平衡两者气压
本题解析:
试题分析:(1)在做制备氯气的实验中用过这些一起,A为分液漏斗。B为锥形瓶。(2)为了使反应顺利进行,反应漏斗的试剂顺利滴下,需要保持压强的内外一致,因此需要导管a这个装置,装置中导管 a 的作用是:将AB连通,平衡两者气压,使液体能顺利流下。(3)本实验的关键是测量气体的体积。根据此装置的原理,应两次记录C中的读数,取其差值就是所得气体的体积,因此干燥管C与量气管D(具有刻度的细长玻璃管)在反应前后液面高度都是相平的。(4)根据所学知识,铝可与强碱溶液反应,离子方程式为:2Al + 2OH— + 2H2O = 2AlO2— + 3H2↑。(5)利用铁离子(Fe3+)的特征反应,遇KSCN溶液变红来检验铁是否参与了反应,方案为:取B 反应后剩余液,加入足量稀硝酸酸化,再滴入KSCN溶液,未见变红(其他方案合理亦可)。(6)根据体积只差算出放出H2的体积,利用化学方程式:Zn+20H-=Zn022-+H2↑,计算出Zn的质量,再用m=ρV=ρSh,得出h=m/(ρS),带入数据,解得h=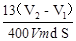 。(7)这题是开放题,只要符合题意的方案都是可以的。
。(7)这题是开放题,只要符合题意的方案都是可以的。
点评:本题考查的是化学实验的基本操作及相关计算,测重基本实验操作能力考查。化学计算注重解题技巧,尤其是最后一题考查思维的深刻性和灵活性。
本题难度:一般
2、选择题 用标准浓度的盐酸滴定未知浓度的NaOH溶液,下列各操作(其他操作正确)中会造成测定结果偏低的是
A.酸式滴定管尖嘴部分有气泡,滴定后消失
B.滴定终点读数时俯视读数
C.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
D.锥形瓶水洗后未干燥
参考答案:B
本题解析:略
本题难度:简单
3、简答题 某元素最高价氧化物的化学式是RO2,已知其气态氢化物中含氢25%.
(1)计算R的相对原子质量;
(2)写出R最高价氧化物对应的水化物的化学式,并设计一个实验方案证明其酸性比盐酸弱.
参考答案:(1)在RO2中R呈+4价,则在氢化物中呈-4价,即氢化物是
本题解析:
本题难度:一般
4、选择题 下列各组气体或溶液用括号内试剂加以鉴别,其中合理的是( )
A.氯化铵、硫酸铵、碳酸铵(氢氧化钡溶液)
B.氯化钠、硫酸钠、碳酸钠(硝酸银溶液、稀盐酸)
C.硫酸、硝酸钡、氯化钾(碳酸钠溶液)
D.盐酸、硝酸钠、醋酸钠(酚酞试液)
参考答案:A、把氢氧化钡溶液分别加入三种溶液中,微热,有气泡冒出的是氯
本题解析:
本题难度:简单
5、填空题 (16分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
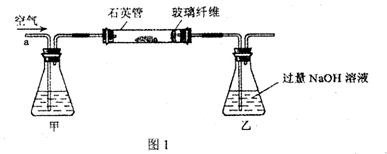
II.反应结束后,将乙瓶中的溶液进行如图2处理。
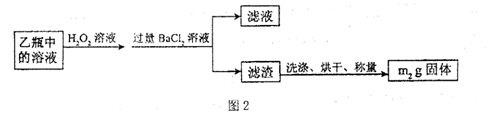
[实验二]测定铁元素的含量。III。测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2+)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是??????????。
(2)I中,甲瓶内所盛试剂是????????溶液;乙瓶内发生反应的离子方程式有?????;I中玻璃纤维的作用是?????????????。
(3)II中,所加H2O2溶液需足量的理由是????????????。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有??????????;
(5)该黄铁矿中硫元素的质量分数?????????(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数?????????(用I、II中有关实验数据表达)
参考答案:(1)FeS2(s) + 11/4 O2 (g)= 1/2F
本题解析:I.黄铁矿灼烧的化学方程式为:FeS2+ 11/4 O2 = 1/2Fe2O3+ 2SO2,由题目所给数据可计算出1molFeS2完全反应所放出的热量为853kJ,则热化学方程式为:FeS2(s) + 11/4 O2 (g)= 1/2Fe2O3(s) + 2SO2(g) △H=-853KJ/mol
(2)I中,甲瓶内所盛试剂是为了吸收SO2,一般用碱液NaOH溶液:SO2 + 2OH- = SO32- + H2O;I中玻璃纤维主要是为了防止粉尘进入导管和乙装置,以防造成实验误差
(3)乙中为亚硫酸盐,加入过量双氧水是为了将SO32-全部氧化SO42-
(4)将滤液稀释至250mL主要应用容量瓶进行操作,期间需要用到胶头滴管、量筒等仪器
(5)由S~BaSO4可知,硫元素的质量分数为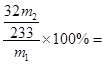 32m2/233m1×100%
32m2/233m1×100%
由5Fe~5Fe2+~KMnO4可知,铁元素的质量分数为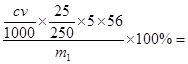 2.8cV/m1×100%
2.8cV/m1×100%
本题难度:一般