时间:2017-02-07 15:06:27
1、选择题 下列图像表达正确的是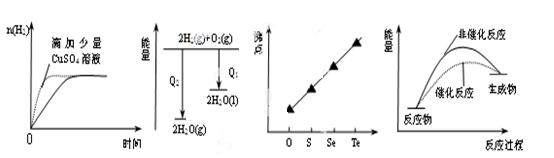
A.等质量锌粉与足量盐酸反应
B.氢气与氧气反应中的能量变化
C.气态氢化物沸点
D.催化反应与非催化反应过程中的能量关系
参考答案:D
本题解析:
加入CuSO4形成原电池,加快了反应速率,但锌粉与一部分硫酸铜反应被消耗,故产生H2的量应不相同,A错;氢气与氧气反应是放热反应,生成气态放出的热量要比生成液态水时要少,B错;液态水的沸点比H2S的沸点高,C错;催化剂能降低反应的活化能,D正确。
本题难度:一般
2、填空题 砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ;砷与溴的第一电离能较大的是 。?
(2)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是 。?
(3)Na3AsO4可作杀虫剂。As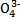 的空间构型为 ,与其互为等电子体的一种分子为 。?
的空间构型为 ,与其互为等电子体的一种分子为 。?
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的化学式为 ,As原子采取 杂化。?
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 个Ga相连,As与Ga之间存在的化学键有 (填字母)。?
A.离子键
B.σ键
C.π键
D.氢键 E.配位键 F.金属键 G.极性键
参考答案:(1)[Ar]3d104s24p3 Br(或溴)
(2
本题解析:(1)从K开始数数到As为15,所以As的核外电子排布式为[Ar]3d104s24p3,为第四周期ⅤA族的元素,第一电离能小于同周期第ⅦA族的元素;(4)As、O最外层电子数分别为5、6,分别形成3、2个共价键达到8电子稳定结构,所以黑球为O、灰球为As;As形成3个σ键,参加成键的电子数为3,孤对电子对数= =
=
本题难度:一般
3、选择题 按要求填空。
(1)一核10电子的原子的电子式_____。
(2)一核10电子阳离子的符号_____。
(3)一核10电子的阴离子的电子式_____。
(4)两核10电子的共价化合物的化学式____________________。
(5)三核10电子的共价化合物的电子式_____。
(6)四核10电子的阳离子的电子式_____。
(7)四核10电子的共价化合物的结构式_____。
(8)五核10电子的阳离子的化学式_____。
(9)五核10电子的共价化合物的结构式_____。
参考答案:本题解析:以Ne原子作标准,与Ne原子同周期的C、N、O、F原子分别得4、3、2、1个电子变为10电子结构,在Ne下一周期的Na、Mg、Al分别失去1、2、3个电子变为10电子结构。
本题难度:简单
4、选择题 下列过程中化学键未被破坏的是[???? ]
A.干冰升华
B.溴与H2生成HBr
C.SO2气体溶于水
D.NaCl固体溶于水
参考答案:A
本题解析:
本题难度:简单
5、选择题 下列物质中属于共价化合物的是(???)
A.Cl2
B.NH4Cl
C.HCl
D.NaOH
参考答案:C
本题解析:Cl2为单质,NH4Cl、NaOH 均为离子化合物;
本题难度:简单