8.51×10-16
?
下列说法不正确的是( )
A.五种物质在常温下Ag2SO4饱和溶液中c(Ag+)最大
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.对于氯化银、溴化银和碘化银三种物质在常温下的饱和溶液中c(Ag+)随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
参考答案:C
本题解析:由溶度积的数据可知:AgCl、AgBr、AgI三种物质在常温下的饱和溶液中c(Ag+)随着氯、溴、碘的顺序而减小,C错误,又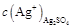 = =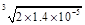 本题难度:一般 本题难度:一般
2、选择题 用石墨电极在一定温度下电解K2SO4饱和溶液m g。当阴极产生a mol气体时,从溶液中析出n g无水晶体。则剩余溶液的溶质质量分数是??????????????????(????)
A.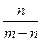
B.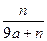
C.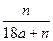
D.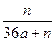
参考答案:C
本题解析:略
本题难度:简单
3、选择题 在2 mL物质的量浓度相等的NaCl和NaI溶液中滴入几滴AgNO3溶液,发生的反应为 [???? ]
A.只有AgCl沉淀生成
B.只有AgI沉淀生成
C.生成等物质的量的AgCl和AgI沉淀
D.两种沉淀都有,但以AgI为主
参考答案:B
本题解析:
本题难度:一般
4、填空题 (16分)
(1)等物质的量的A和B,混合于2L的密闭容器中,发生反应3A(g)+B(g)=xC(g)+2D(g),经过5min时,测得D的浓度为1mol/L,c(A):c(B)=3:4,C的反应速率是0.2mol?L-1?min-1,A在5min末的浓度是______,x的值是______.
(2)1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图(各物质为气体)

写出NO2和CO反应的热化学方程式____________________
(3)已知可逆反应:M(g)+N(g)  P(g)+Q(g);△H>0,请回答下列问题: P(g)+Q(g);△H>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为____
②平衡后,升高温度,平衡常数 。(增大、减小)
(4)t ℃时,水的离子积常数为1×10-13,则该温度 25℃(填大于,小于)。若将此温度下PH=11的苛性钠溶液a L与PH=1的稀硫酸b L混合(忽略混合后体积变化),若所得混合液为中性,则a :b= 。
(5)已知298K时, Ksp(CaCO3)=2.80×10-9, Ksp(CaSO4)=5.6×10-5 ,求此温度下该反应 的平衡常数K的数值为____ 的平衡常数K的数值为____
参考答案:(1)3 mol/L,x=2(2)NO2(g)+CO(g)=
本题解析:
试题分析:(1)假设AB的物质的量为n,D的浓度为1mol/L,所以D的物质的量为2摩尔,则列式计算:
3A(g)+B(g)=xC(g)+2D(g)
起始物质的量 n n 0 0
改变物质的量 3 1 x 2
5分末的物质的量 n-3 n-1 x 2
(n-3)/(n-1)=3/4 解n=9摩尔, x÷2÷5=0.2 x=2,所以A在5分末的浓度为(9-3)/2="3" mol/L,x=2。(2)根据图像分析1摩尔二氧化氮和1摩尔一氧化碳反应放热为364-134=234kJ的热量,热化学方程式写为:NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234 kJ·mol-1。(3)①M的转化率为60%,则反应的M的物质的量浓度为1×60%=0.6 mol·L-1,根据反应方程式分析,N反应的物质的量浓度也为0.6 mol·L-1,则N的转化率=0.6/2.4=25%。②由于正反应为吸热,所以升温平衡正向移动,平衡常数增大。(4)因为常温下水的离子积常数为10-14,电离吸热,常数增大,说明平衡正向移动,温度升高,即温度大于25℃。在此温度下,pH=11的氢氧化钠溶液中氢氧根离子浓度=0.01 mol?L-1,pH=1的硫酸溶液中氢离子浓度为0.1 mol?L-1,弱酸碱混合后为中性,则氢离子和氢氧根离子物质的量相等,即体积比为10:1。(5)该反应的平衡常数=c(SO42-)/c(CO32-)= Ksp(CaSO4)/ Ksp(CaCO3)= 5.6×10-5/2.80×10-9=2×104。
考点:化学平衡计算,热化学方程式书写,化学平衡常数,酸碱混合。
本题难度:困难
5、选择题 已知下列反应:①NH3+H+=NH4+??②Ag++2NH3=Ag(NH3)2+?③Ag++Cl-=AgCl
前者都比后者更容易发生。下列事实或现象预期错误的是
A.氯化银可溶于氨水
B.银氨溶液中加入氯化钠溶液有白色沉淀
C.银氨溶液中加入盐酸有白色沉淀
D.银镜反应的残留液可用稀硝酸处理
参考答案:B
本题解析:略
本题难度:一般
|