时间:2017-02-07 15:01:51
1、选择题 下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
D.生铁浸泡在食盐水中发生吸氧腐蚀
参考答案:D
本题解析:降低生成物浓度,平衡向正反应方向移动,但正反应速率降低。粗锌中含有杂质,可与锌构成原电池加快反应速率,B不正确。铁比锡活泼,锌比铁活泼,所以镀层破损后,镀锌铁板比镀锡铁板更耐腐蚀,C不正确。食盐水显中性,在此环境下,铁发生吸氧腐蚀,D正确。答案D。
本题难度:一般
2、选择题 下列说法不正确的是(????)
A.通过煤的干馏可以获得焦炭
B.煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来
C.通过煤的干馏可以获得粗氨水
D.煤液化后可以得到甲醇
参考答案:B
本题解析:略
本题难度:简单
3、选择题 “绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用。下列化学反应,不符合绿色化学理念的是 [???? ]
A.消除硝酸工业尾气的氮氧化物: NO2+NO+2NaOH = 2NaNO2+H2O
B.制Cu(NO3)2:3Cu+8HNO3(稀)= 3Cu(NO3)2+2NO↑+4H2O
C.将宴验室的废酸液和废碱液中和后再排放如: H2SO4+2NaOH = Na2SO4+2H2O
D.制CuSO4: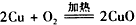 ,CuO+ H2SO4 (稀) ?= CuSO4+H2O
,CuO+ H2SO4 (稀) ?= CuSO4+H2O
参考答案:B
本题解析:
本题难度:一般
4、计算题 硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。
(1)将SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀。溶液由棕黄色变为浅绿色用离子方程式表示为_____,后又由浅绿色变为棕黄色的离子方程式为_____。
(2)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCI为原料可以合成有重要用途的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下: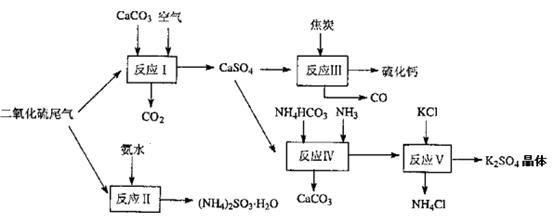
写出反应反应Ⅳ的化学方程式????????????????????;
反应III中氧化剂与还原剂的物质的量之比为__?????????__;
反应V在25"C、40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是?????????。
(3)新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下能使SO2分解,减小工业废气对环境的影响,它由铁酸锌(ZnFe2O4)经高温还原制得,转化流程如下图所示: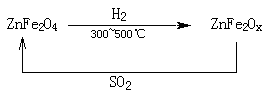
若2molZnFe2Ox与SO2反应可生成 0.75molS,x=??????,写出铁酸锌高温下被还原生成氧缺位铁酸锌的化学方程式???????????????????
(4)石灰石-石膏湿法烟气脱硫工艺技术的原理是烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4.2H2O),写出该反应的化学方程式?????????。某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则可生产石膏?????????t。
参考答案:(共16分)(1)SO2 + 2Fe3+ + 2H2O=SO
本题解析:
试题分析:(1)SO2具有还原性,铁离子具有氧化性,铁离子能把SO2氧化生成硫酸,而铁离子被还原为亚铁离子,所以溶液由棕黄色变为浅绿色,反应的离子方程式是SO2 + 2Fe3+ + 2H2O=SO42- + 2Fe2+ + 4H+。由于在酸性条件下,NO3-具有强氧化性,能把亚铁离子氧化生成铁离子,因此又由浅绿色变为棕黄色,反应的离子方程式为3Fe2+ + NO3- + 4H+=3Fe3+ + NO↑+ 2H2O。
(2)反应Ⅳ的反应物有硫酸钙、碳酸氢铵和氨气,生成物之一是碳酸钙,则根据原子
本题难度:一般
5、选择题 充分利用能源、提高原子利用率、减少向环境排放废弃物等都是绿色化学基本要求.
①在有机实验中,用溴的四氯化碳溶液代替溴的水溶液;②用稀硝酸代替浓硝酸溶解、回收含银镜试管里的银;?③用水浴加热代替直接用酒精灯加热;④接触法制硫酸中采用“热交换器”,利用余热预热冷原料气;⑤工业合成氨中分离产物得到氢气和氮气再循环使用;?⑥电解法冶炼铝,选择电解金属氧化物,不电解对应的氯化铝.
上述主要不是从绿色化学角度考虑的是( )
A.①③⑥
B.②④⑤
C.⑤⑥
D.②③④
参考答案:A
本题解析:
本题难度:一般