时间:2017-02-07 14:52:54
1、选择题 某容器中发生一个化学反应,反应过程中存在As2S3、HNO3、H2SO4、NO、H3AsO4、H2O六种物质,已知As2S3是反应物之一.下列有关判断不?正确的是
A.该容器中发生了氧化还原反应
B.该反应中HNO3、H2O是反应物,H2SO4、NO、H3AsO4是生成物
C.该反应中只有砷元素被氧化、只有氮元素被还原
D.HNO3、H2SO4、H3AsO4都属于最高价氧化物的水化物
参考答案:C
本题解析:分析:在题干中,各类化合物化合价有升有降,可以初步推断该容器中发生了氧化还原反应,As2S3是反应物,反应中硫元素化合价从-2升到+6价被氧化了,砷元素化合价从+3升到+5价的H3AsO4被氧化,六种物质中硝酸具有强氧化性,所以一氧化氮是还原产物,综合分析可知反应物是As2S3、H2O、HNO3,生成物是NO、H3AsO4、H2SO4;
解答:A、反应过程中元素化合价变化说明是发生了氧化还原反应,故A正确;
B、依据氧化还原反应的化合价升降可知,该反应中As2S3、HNO3、H2O是反应物,H2SO4、NO、H3AsO4是生成物,故B正确;
C、As2S3被氧化生成了H2SO4、H3AsO4,硫元素也被氧化,故C错误;
D、HNO3、H2SO4、H3AsO4中氮、硫、砷元素化合价都是最高价,都属于最高价氧化物的水化物,故D正确;
故选C.
点评:本题考查了氧化还原反应的化合价升降守恒,产物的分析判断,氧化还原反应的概念应用,题目较难,需要熟练掌握氧化还原反应的基本概念的应用.
本题难度:困难
2、选择题 Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物n(NO2)∶n(NO)=1∶1时,下列说法正确的是
A.产物硝酸铜和硫酸铜的物质的量之比是1∶1
B.参加反应的n(Cu2S)∶n(HNO3)=1∶5
C.反应中Cu2S既做氧化剂,又做还原剂
D.1 molCu2S参加反应时有8 mol电子转移
参考答案:A
本题解析:
试题分析:根据方程式可知,铜元素的化合价从+1价升高到+2价,失去1个电子,S元素的化合价从-2价升高到+6价,失去8个电子,因此1 molCu2S参加反应时有10mol电子转移,C和D不正确。而氮元素的化合价从+5价部分降低到+2价,得到3个电子,部分降低到+4价,得到1个电子。由于n(NO2)∶n(NO)=1∶1,所以如果设生成的NO和NO2都是1mol,则根据电子的得失守恒可知,参加反应的硫化铜的物质的量是4÷10=0.4mol电子。因此生成硫酸铜就是0.4mol,则生成硝酸铜就是0.8mol-0.4mol=0.4mol,A正确;根据原子守恒可知,参加反应的硝酸是2mol+0.4mol×2=2.8mol,则参加反应的n(Cu2S)∶n(HNO3)=0.4∶2.8=1∶7,B不正确,答案选A。
考点:考查氧化还原反应的有关判断和计算
点评:该题在进行有关计算时,应该注意充分利用电子的得失守恒以及原子守恒等关系式,以简化计算过程。
本题难度:一般
3、选择题 将m1 g锌加到m2 g 20%的HCl溶液中去,反应结果共放出n L 氢气(在标准状况下),则被还原的HCl的物质的量是
[???? ]
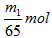
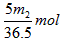

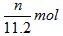
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列物质中,属于电解质的是
A.氯气
B.二氧化碳
C.氯化钠
D.蔗糖
参考答案:C
本题解析:分析:电解质是指:该物质是化合物,溶于水溶液中或在熔融状态下就能够导电,是自身电离.酸、碱、盐都是电解质,在水溶液中和在熔融状态下两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物既不是电解质也不是非电解质.据此即可解答.
解答:A.无论电解质,还是非电解质,都是指化合物,Cl2?是单质,故既不是电解质,也不是非电解质,故A错误;
B.二氧化碳常温下为气体,只有CO2分子,没有自由移动的离子,虽CO2在水溶液中与水反应,生成碳酸,碳酸电离出自由移动的离子,溶液能够导电,但自由移动的离子不是CO2自身电离.CO2是化合物,故CO2是非电解质,故B错误;
C.NaCl在溶液中或熔融状态下,有自由移动的钠离子和氯离子,能导电,氯化钠是电解质,故C正确;
D.蔗糖在水溶液中或熔融状态下只有蔗糖分子,没有自由移动的离子,不导电,是化合物,是非电解质,故D错误;
故选C.
点评:本题考查电解质概念的辨析,解答该类概念性题目,应对概念十分清晰,抓住概念中的关键词,并注意大多数有机化合物都是非电解质,单质,混合物既不是电解质也不是非电解质,题目较简单.
本题难度:困难
5、选择题 铁氧磁体法处理Cr2O72-的废水的原理可概述为:向Cr2O72-的酸性废水中加入FeSO4·7H2O,将Cr2O72-还原为Cr3+,调节溶液的pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢXCrⅢ2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含1 mol Cr2O72-的废水至少需要加入amol FeSO4·7H2O。下列结论正确的是[???? ]
A.x= 0.5 , a= 8
B.x = 0.5 , a=10
C.x = 1.5 , a= 8
D.x = 1.5 , a= 10
参考答案:D
本题解析:
本题难度:一般