时间:2017-02-07 14:45:35
1、计算题 有镁铝合金10.2 g,将它溶于500 mL 4 mol·L-1的盐酸里,若要使沉淀质量达到最大值,则需加入2 mol·L-1氢氧化钠溶液的体积为多少?
参考答案:1000 mL
本题解析:此题考查镁、铝单质及其化合物的化学性质。题目中涉及四个化学反应,若是用化学方程式来列式计算,十分烦琐,而且计算量大。如果分析题意,不难发现当沉淀达到最大值的时候,即镁、铝元素分别与氢氧根离子完全结合生成沉淀,运用守恒定律,溶液中的阳离子只能为钠离子,阴离子必为氯离子,且二者的物质的量相等,所以n(NaOH)="0.5" L×4 mol·L-1="2" mol,V(NaOH)= 本题难度:简单
本题难度:简单
2、选择题 能用来分离Fe3+和Al3+离子的试剂是
A.KSCN
B.NH3· H2O
C.NaOH溶液
D.H2S溶液
参考答案:C
本题解析:
正确答案:C
A、KSCN与Fe3+生成络合物,不沉淀,无法分离; B.NH3· H2O与Fe3+和Al3+离子均生成沉淀; C.NaOH溶液:Fe3++3OH―=Fe(OH)3↓,Al3++4OH―=AlO2―+2H2O一个沉淀,一个生成溶液,可分离; D.H2S溶液与Fe3+发生氧化还原反应,生成Fe2+仍在溶液中,无法分离。
本题难度:一般
3、选择题 用铝热剂冶炼难熔金属,是因为铝是( )
A.具有导电性
B.具有延展性
C.既能与酸反应又能与碱反应
D.被氧化过程中放出大量的热
参考答案:用铝热剂冶炼难熔金属,是因为铝被氧化过程中放出大量的热,使置
本题解析:
本题难度:简单
4、填空题 铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提炼Al2O3并制取铝的流程如下: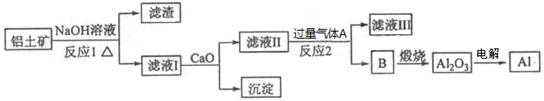
请回答下列问题:
(1)铝与NaOH溶液反应的离子方程式为??????????????????????????????????。
(2)图中涉及分离溶液与沉淀的玻璃仪器有烧杯、玻璃棒、_________。
(3)反应1涉及的化学方程式有?????????????????????、??????????????????????????。滤液Ⅰ中加入CaO生成的沉淀是_?????(填化学式)。
(4)向滤液Ⅱ中通入气体A为??????????????,生成沉淀B的离子方程式为??????????????????????。
参考答案:(1)2Al+2H2O+2OH-=2AlO2-+3H2↑??
本题解析:
试题分析:(1)铝与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑;(2)图中涉及分离溶液与沉淀的玻璃仪器有烧杯、玻璃棒、漏斗;(3)二氧化硅与氢氧化钠反应生成硅酸钠与水,反应方程式为:2NaOH+SiO2═Na2SiO3+H2O,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:2NaOH+Al2O3═2NaAlO2+H2O;滤液Ⅰ中含有硅酸钠、偏铝酸钠,加入CaO,生成氢氧化钙;(4)由工艺流程可知,B为氢氧化铝,故气体A为二氧化碳,滤液Ⅱ主要是偏铝酸钠,偏
本题难度:一般
5、选择题 下列关于铝的说法不正确的是( )
A.铝是金属元素在地壳中含量最多的元素
B.铝是比较活泼的金属,在化学反应中容易失去电子,表现还原性
C.铝箔在空气中受热可以熔化,且发生剧烈的燃烧
D.日常用的铝制品,表面总是覆盖着一层保护膜
参考答案:A.地壳含量较多的元素(前四种)按含量从高到低的排序为:氧、
本题解析:
本题难度:一般