时间:2017-02-02 07:48:52
1、填空题 锂是密度最小的金属,因其有许多优良的性能而被用来制作锂电池。
(1)写出锂在空气中燃烧的化学方程式____,将7.0 g锂投入足量水中,可得到标准状况下的氢气___L。
(2) Li-SO2电池具有输出功率高、低温、性能好等优点,其电解质为LiBr,溶剂是碳酸丙烯酯和乙腈,Li+可在其中移动。电池总反应式为2Li +2SO2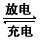 Li2S2O4下列有关该电池的说法正确的是___。
Li2S2O4下列有关该电池的说法正确的是___。
A.该电池总反应为可逆反应
B.充电时阴极反应式为Li++e-=Li
C.放电时Li+向负极移动
D.该电池电解质溶液可换成LiBr水溶液
(3) LiH遇水发生强烈的水解,写出它水解的化学方程式___,所得溶液的pH___ (填“>”、“=”或“<”)7,LiH的电子式为__。
(4)Li2SO4在水溶液中可以发生微弱的水解,试判断下列关系式正确的是___。
A.c(Li+)+c(H+)=c(OH-)+c(SO42-)
B.c(Li+)+c(H+)=c(OH-)+2c(SO42-)
C.2c(Li+) +2c(H+) =2c(OH-)+c( SO42-)
D.c(Li+) =2c(SO42-)
参考答案:(1)4Li+O2本题解析:
本题难度:一般
2、选择题 25℃时,浓度均为0.1 mol/L的NaHCO3和Na2CO3溶液中,都存在的离子浓度关系是[???? ]
A. c(H+)·c(OH-)=10-14
B. c(Na+)+c(H+)=c(CO32-)+c(OH-) +c(HCO3-)?
C. c(Na+)=c(CO32-)+c(HCO3-) +c(H2CO3)
D. c(Na+)>c(HCO3-)+c(CO32-)>c(OH-)>c(H+)
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列说法正确的是( )
A.等物质的量浓度的硫酸氢铵溶液和氢氧化钠溶液等体积混合:c(S042-)>c(Na+)>C(NH4+)>c(OH-)=c(H+)
B.常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系:c(HB)>c(Na+)>c(B-)>c(H+)>c(OH-)
C.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的pH<7
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,若混合液pH=7,则溶液中:2c(R2-)+c(HR-)=c(Na+)
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列说法中,正确的是??[???? ]
A.0.1?mol/L醋酸钙溶液中,c(Ca2+ )>c(CH3COO-)> c(OH-)>c(H+) ??
B.体积相同、pH相同的NH4?Cl溶液和盐酸,完全溶解少量且等量的锌粉,前者用时少??
C.将nmol?H2(g)、nmol?I2?(g)和2n?mol?H2?(g)、2n?mol?I2?(g)??分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 ??
D.某物质的溶液中由水电离出的c(H+)=1×10-a?mol·L-1,若a>7时,则该溶液的pH一定为14-a
参考答案:B
本题解析:
本题难度:一般
5、选择题 取0.2mol?L-1?HX溶液与0.2mol?L-1?NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是( )
A.混合溶液中由水电离出的c(OH-)小于0.2?mol?L-1?HX溶液中由水电离出的c(H+)
B.c(Na+)=c(X-)+c(HX)=0.2?mol?L-1
C.c(Na+)-c(X-)=9.9×10-7?mol?L-1
D.c(OH-)=c(HX)+c(H+)=1×10-8?mol?L-1
参考答案:取0.2mol?L-1?HX溶液与0.2mol?L-1?Na
本题解析:
本题难度:简单