时间:2017-02-02 07:35:48
1、选择题 用一充满氨气的烧瓶做喷泉实验,当水充满整个烧瓶后,烧瓶内的氨水的物质的量浓度是(按标准状况下计算)[???? ]
A.0.045 mol/L
B.1 mol/L
C.0.029 mol/L
D.不能确定
参考答案:A
本题解析:
本题难度:简单
2、实验题 (8分)用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题
(1)请写出该实验的实验步骤
①计算,②称量,③ ,④冷却,⑤移液,⑥洗涤并移液,⑦ ,⑧ 摇匀。
(2)所需仪器为:500mL容量瓶、托盘天平、玻璃棒、烧杯,还必需一个仪器,该仪器的名称是: 。使用容量瓶前必须进行的操作是 。用托盘天平称取氯化钠固体的质量是________g
(3)试分析下列操作对所配溶液的浓度有何影响。(填“偏高”或“偏低”或“无影响”)
①容量瓶没有干燥,有少量的蒸馏水:
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度: 。
③定容是俯视刻度线: 。
参考答案:(1)溶解;定容(2)胶头滴管;检查是否漏水;29.3(3)
本题解析:考查一定物质的量浓度溶液的配制及有关误差分析。
(1)根据实验的原理可知,基本的实验步骤是①计算,②称量,③溶解,④冷却,⑤移液,⑥洗涤并移液,⑦定容,⑧ 摇匀。
(2)定容时需要胶头滴管,所以还缺少的仪器是胶头滴管;容量瓶在使用之前必须检验是否漏水;500mL1.00mol/L的NaCl溶液中含有溶质是0.5L×1.00mol/L=0.5mol,所以其质量是0.5mol×58.5g/mol=29.3g。
(3)根据c=n/V可知,若容量瓶没有干燥,有少量的蒸馏水,但n和V不变,所以浓度不变;液面低于刻度线,又滴加蒸馏水至刻度,则V偏大,浓度偏低;定容是俯视刻度线,则容量瓶中溶液的体积偏小,浓度偏高。
本题难度:一般
3、选择题 将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为 [???? ]
A.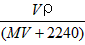
B.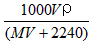
C.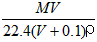
D.100VρM/(MV+2240)
参考答案:B
本题解析:
本题难度:简单
4、选择题 设NA为阿伏伽德罗常数的值,下列说法正确的是
A.1L0.1mol?L-1的氨水含有0.1 NA个NH4+
B.84gNaHCO3晶体中含有 NA个 HCO3-
C.1 mol Fe在氧气中充分燃烧失去的电子数为3NA
D.64 g铜片与足量稀HNO3反应生成NA个NO分子
参考答案:B
本题解析:
试题分析:A、NH3?H2O为弱碱,部分电离,所以1L0.1mol?L-1的氨水含有NH4+小于0.1 NA,故A错误;B、84gNaHCO3物质的量为1mol,则含NA个 HCO3-,故B正确;C、Fe在氧气中充分燃烧生成Fe3O4,失去电子数为 8/3 NA,故C错误;D、铜与稀硝酸反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,64 g铜为1mol,则生成的NO为2/3mol,分子数目为2/3NA,故D错误。
考点:本题考查阿伏伽德罗常数的计算。
本题难度:一般
5、选择题 300mL某浓度的NaOH溶液中含有60g溶质。现要配制1mol/L NaOH溶液,应取原溶液与蒸馏水的体积比约为(??)
A 1:4 ???????????B 1:5????????? C 2:1???????????? D 2:3
参考答案:A
本题解析:根据溶液中稀释前后溶质的物质的量守恒。
原NaOH溶液的浓度是:  ,
,
假设原溶液与水混合时体积不变。依据稀释前后溶质的物质的量不变得: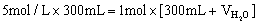 本题难度:简单
本题难度:简单