时间:2017-02-02 07:34:50
1、填空题 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知:
2CO(g)+O2(g)=2CO2(g)??△H=-566kJ/mol?
2Fe(s)+3/2O2(g)=Fe2O3(s)?△H=-825.5?kJ/mol
反应:Fe2O3(s)+3CO(g)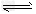 2Fe(s)+3CO2(g)??△H=_______kJ/mol。
2Fe(s)+3CO2(g)??△H=_______kJ/mol。
II.反应?1/3Fe2O3(s)+CO(g)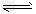 2/3?Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡。
2/3?Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡。
(1)CO的平衡转化率=?_____________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度????b.增大反应体系的压强 c.选取合适的催化剂???
d.及时吸收或移出部分CO2? e.粉碎矿石,使其与平衡混合气体充分接触
III.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇: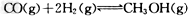 ??。请根据图示回答下列问题:
??。请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率?(H2)=?________。 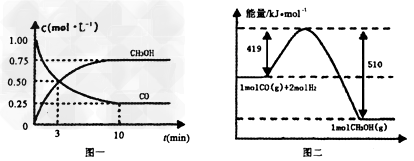
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表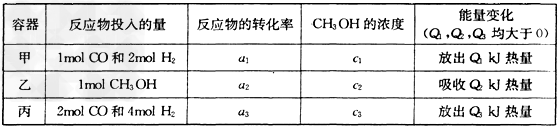
则下列关系正确的是________。
A.c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1?+a2?=1
E.该反应若生成1mol?CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l?molCO、2mol?H2和1mol?CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动。
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式__________________。
参考答案:I.-23.5? 本题解析: 本题难度:一般 2、填空题 苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g) 参考答案:(1) 本题难度:一般 3、填空题 在T1℃时,向容积为2 L的密闭容器甲中加入1molA 气体、3mol B气体及少量固体催化剂,发生下列反应:A(g)+3B(g) 参考答案: (1)0.06 mol/(L·min);40% 本题解析: 本题难度:一般 4、选择题 对于密闭容器中的可逆反应:mX(g)+nY(s) 参考答案:C 本题解析: 本题难度:一般 5、简答题 下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫. 参考答案:(1)工业接触法制硫酸三步骤:第一步:SO2的制取,第二步: 本题解析: 本题难度:一般
II.(1)?60%;(2)d
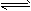 C6H5CH=CH2(g)+
C6H5CH=CH2(g)+
H2(g) △H=+125kJ/mol
(1)该反应的平衡常数表达式为K=_______。随着温度的升高,K值________(填“增大”“减小”或“不变”)。
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C6H5C2H5的平衡转化率与水蒸气的用量、体系总压强关系如下图。 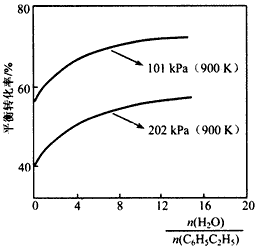
①由上图可得出:
结论一:其他条件不变,水蒸气的用量越大,平衡转化率越____;
结论二:____________。
②加入稀释剂能影响C6H5C2H5平衡转化率的原因是:__________________。
(3)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高C6H5C2H5的平衡转化率。试解释其原因:____________________。
本题解析:
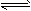 2C(g);△H
2C(g);△H 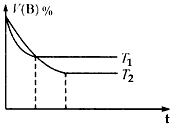
(1)计算该反应在0~10 min时间内B的平均反应速率为________,A的转化率为_______
(2)在T1℃时,若起始在容器甲中只加入1.0 molC,则达到平衡时C的体积分数____。
a.大于25% b.等于25% c.小于25%
(3)上图分别表示的是在T1℃和T2℃时,密闭容器甲中气体B的体积分数随时间(t)变化的曲线,试判断T1 ____(填“<”“>”或“=”)T2。
(4)若保持T1℃,在体积也为2L的密闭容器乙中通入一定量的A、B、C三种气体,欲使平衡时容器乙中各物质的物质的量与容器甲中完全相同,且起始时反应向正反应方向进行,则通入B的物质的量x的取值范围是_____________________
 pZ(g);ΔH<0.达化学平衡后,改变条件,下列表述不正确的是 [???? ]
pZ(g);ΔH<0.达化学平衡后,改变条件,下列表述不正确的是 [???? ]
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡不一定发生移动
D.其他条件不变,升高温度,化学平衡一定发生移动
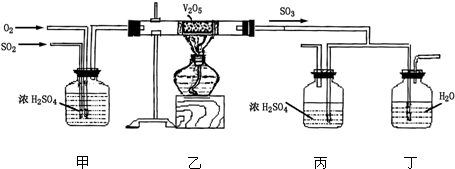
请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的化学方程式______;
(2)上图中的乙、丙分别相当于工业上制取硫酸设备中的______、______;
(3)丁中的现象为______;
(4)下图是压强对SO2平衡转化率的影响:转化率%? 压强/MPa? 温度/℃ 0.1 0.5 1 10
400
99.2
99.6
99.7
99.9
500
93.5
96.9
97.8
99.3
600
73.7
85.8
89.5
96.4
对SO2转化为SO3的反应,增大压强可使转化率______,工业生产中通常采用常压操作的原因是______.