369
H2(g)+Br2(l)=2HBr(g) ΔH= 。
(2)常温下,将pH均为2的氢溴酸、乳酸(α—羟基丙酸)稀释100倍后,有一种酸的pH=4。请写出乳酸钠溶液中的水解离子方程式: 。
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示: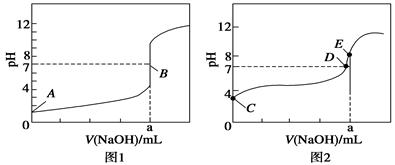
①根据图1和图2判断,滴定HBr溶液的曲线是 (填“图1”或“图2”);
②a= mL;
③c(Na+)=c(CH3COO-)的点是 点;
④E点对应溶 91exam .org液中离子浓度由大到小的顺序为 。
3、填空题 (1)某温度下纯水的c(H+)=2.0×10-7mol/L。在此温度下,某溶液中由水电离出的c(H+)为4.0× 10-13 mol/L,则该溶液的pH可能是____。
(2)分别将少量CO2气体通入一元酸的钠盐NaA和NaB的溶液中,发生的反应为:
①CO2+2NaA+ H2O==Na2CO3+2HA;
②CO2+NaB+H2O==NaHCO3+HB,
试由此推断H2CO3、HCO3-、HA、HB 的电离程度由大到小顺序为___。
(3)已知在相同条件下,HCN的电离程度比HF小。请根据有关知识分析判断,在相同温度下,物质的量浓 度相同的NaCN溶液和NaF溶液中: [c(CN-)+c(OH-)]____[f(F-)+c(OH-)]
(选填“等于”、“大于”或“小于”)。
4、填空题 (12分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]
5、选择题 25℃,pH=3的醋酸溶液(I)和pH=ll的氢氧化钠溶液(II),下列说法正确的是(??? )
A.I和II中H2O的电离程度不相等
B.将I稀释l0倍,溶液中c(CH3COOH)、c(OH﹣)均减小
C.I和II溶液混合,若c(OH﹣)>c(H+),则氢氧化钠一定过量
D.I和II等体积混合后,溶液中离子浓度大小为c(CH3COO﹣)+ c(CH3COOH>c(Na+)
|