时间:2017-02-02 07:22:07
1、选择题 在标准状况下,一体积水溶解42体积SO2,则所得亚硫酸的质量分数为
A.10.7%
B.13.3%
C.2.4%
D.97.6%
参考答案:B
本题解析:取1 L水,质量为1 000 g,SO2的物质的量n=42 L/22.4(L·mol-1)等于生成的亚硫酸的物质的量,因此生成亚硫酸的质量m=42L/22.4(L·mol-1)×82 g·mol-1=153.75 g.质量分数为153.75 g/(1 000 g+153.75 g)×100%=13.3%.
本题难度:困难
2、选择题 含有非极性共价键的化合物是
A.CO2
B.CaCl2
C.C2H6
D.NaOH
参考答案:C
本题解析:共价键分成两类:同种原子间形成非极性共价键,不同种原子间形成极性共价键;
A中碳、氧原子间是极性共价键;B中Ca2+、Cl-间为离子键;C中碳、氢原子间为极性共价键,碳、碳原子间为非极性共价键;D中Na+、OH-间为离子键,OH-内氢、氧原子间为极性共价键;
本题难度:一般
3、选择题 在相同条件下,将相同物质的量的Na、Mg、Al分别加入盛有同浓度、同体积稀盐酸的甲、乙、丙三个烧杯中充分反应,生成气体的体积关系不可能是
A.甲(Na)>乙(Mg)>丙(?Al)
B.甲(Na)>乙(Mg)=丙(?Al)
C.甲(Na)<乙(Mg)<丙(?Al)
D.甲(Na)=乙(?Mg)=丙(Al)
参考答案:A
本题解析:分析:分情况讨论:
①酸不足量,且三种金属与酸反应后都过量时;
②三种金属都不足量、酸过量时;
③酸不足量且钠与酸恰好完全反应时;
然后依据发生的化学反应来分析.
解答:三种金属与酸反应的方程式分别为:
2Na+2HCl=2NaCl+H2↑、Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,
A、镁、铝只和酸反应,钠和酸、水都反应,无论酸过量还是金属过量,都不会出现甲(Na)>乙(Mg)>丙(Al),故A错误;
B、酸不足量,且三种金属与酸反应后都过量时,镁、铝只和酸反应,所以乙、丙两支试管得到的氢气全部来自于酸,所以产生的氢气体积相同;钠不仅和酸反应还和水反应,所以甲试管的氢气来自于为水和酸,导致甲试管得到的氢气体积大于乙、丙两支试管得到的氢气,故B正确;
C、三种金属不足量、酸过量时,以金属为标准进行金属,根据方程式知,生成的氢气最多的为铝,其次为镁,最少的为钠,故C正确;
D、酸不足量且钠与酸恰好完全反应时,生成的氢气全部来自于酸,因为酸的量相同,所以生成的氢气相同,故D正确;
故选A.
点评:本题考查了有关方程式的计算及过量问题,难度不大,注意钠不仅和酸反应还和水反应,这是解题的易错点.
本题难度:简单
4、选择题 常温下,下列气体不能共存的是
A.NO和CO2
B.SO2和O2
C.NH3和HCl
D.NH3和O2
参考答案:C
本题解析:分析:常温下,能相互反应的气体不能共存.
解答:A.常温下,一氧化氮和二氧化碳不反应,所以能共存,故A错误;
B.常温下,二氧化硫和氧气不反应,但在催化剂、加热条件下,二氧化硫和氧气能反应生成三氧化硫,故B错误;
C.氨气和氯化氢气体相遇有白烟生成,白烟是氯化铵固体颗粒,所以氯化氢和氨气不能共存,故C正确;
D.氨气和氧气在常温下不反应,但高温、高压、催化剂条件下能反应生成一氧化氮,所以常温下氨气和氧气在常温下能共存,故D错误;
故选C.
点评:常温下能相互反应的气体不能共存,明确物质的性质是解本题关键,难度不大.
本题难度:困难
5、选择题 在标准状况下①6.72L?CH4?②3.01×1023个HCl分子?③13.6g?H2S?④0.2mol?NH3,下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个数①>③>④>②
A.a?b?c
B.b?c?d
C.a?b?c?d
D.a?c?d
参考答案:C
本题解析:分析:a、相同条件下,气体的体积之比等于物质的量之比,据此判断;
b、相同条件下,密度之比等于摩尔质量之比;
c、计算各物质的质量进行比较;
d、计算出各物质的物质的量,结合化学式判断H原子的物质的量,据此解答.
解答:①6.72L?CH4?物质的量为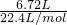 =0.3mol,②3.01×1023个HCl分子的物质的量为0.5mol,③13.6g?H2S?的物质的量为
=0.3mol,②3.01×1023个HCl分子的物质的量为0.5mol,③13.6g?H2S?的物质的量为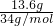 =0.4mol,④0.2mol?NH3.
=0.4mol,④0.2mol?NH3.
a.相同条件下,气体的体积之比等于物质的量之比,所以体积体积②>③>①>④,故a正确;
b.各物质的摩尔质量分别为①CH4?为16g/mol②HCl为36.5g/mol?③H2S?为34g/mol④NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度②>③>④>①,故b正确;
c.各物质的质量分别为①CH4?为0.3mol×16g/mol=4.8g②HCl为0.5mol×36.5g/mol=33.25g?③H2S?13.6g④NH3为0.2mol×17g/mol=3.4g,所以质量②>③>①>④,故c正确;
d.各物质中H原子的物质的量分别为①CH4?为0.3mol×4=1.2mol②HCl为0.5mol③H2S?0.4mol×2=0.8mol④NH3为0.2mol×3=0.6mol,所以氢原子个数①>③>④>②,故d正确.
故选C.
点评:本题考查阿伏伽德罗定律及推论、常用化学计量数的有关计算,难度不大,注意基础知识的掌握.
本题难度:困难