时间:2017-02-02 07:17:34
1、选择题 石墨晶体为层状结构,每一层均为碳原子与周围其他3个碳原子相结合而成平面片层,同层相邻碳原子间距142pm、相邻片层间距为335pm.如图是其晶体结构片层俯视图.下列说法不正确的是( )
A.碳以sp2杂化
B.每个碳形成3个σ键
C.石墨碳原子数与σ键数之比为2:3
D.片层之间碳成共价键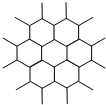
2、选择题 有一种蓝色晶体[可表示为:MxFey(CN)6],经X-射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如图所示。下列说法正确的是 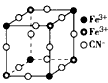 [???? ]
[???? ]
A.该晶体的化学式为MFe2(CN)6
B.该晶体属于离子晶体,M呈+1价
C.该晶体属于离子晶体,M呈+2价
D.晶体中与每个Fe3+距离最近且等距离的CN-为3个
3、选择题 下列可以利用晶体结构来解释的是[???? ]
A.晶体有规则的几何外形,非晶体没有规则的几何外形
B.晶体的各向异性
C.晶体有一定的熔点,非晶体没有一定的熔点
D.晶体的导电性比非晶体好
4、选择题 下列五种烃①2-甲基丁烷②2,2-二甲基丙烷③戊烷④丙烷⑤丁烷,按沸点由高到低的顺序排列的是( )
A.①>②>③>④>⑤
B.②>③>⑤>④>①
C.③>①>②>⑤>④
D.④>⑤>②>①>③
5、填空题 有下列结论:①在晶体中只要有阴离子就一定有阳离子;②在晶体中只要有阳离子就一定有阴离子;③原子晶体的熔点一定比金属晶体高;④分子晶体的熔点一定比金属晶体的低。其中正确的是__________。?