498
Si(s)+O2(g) SiO2(s),该反应的反应热△H=?????????。 SiO2(s),该反应的反应热△H=?????????。
参考答案:(1)AB(1分)??(2)1:4(2分)?? -990 k
本题解析:(1)氧化铝的熔点很高,属于离子晶体,A不正确。根据熔点大小可知,氯化铝也是分子晶体,B不正确。C正确,例如CO2是分子晶体,二氧化硅是原子晶体。D正确,例如氧化钠是离子晶体,CO2是分子晶体,二氧化硅是原子晶体。答案选AB。
(2)在二氧化硅晶体,每个硅原子与4个氧原子相连,所以SiO2晶体中Si和Si—O键的比例为1:4。反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以该反应的反应热是176kJ/mol×2+498kJ/mol-460kJ/mol×4=-990 kJ/mol。
本题难度:简单
2、选择题 关于金属性质和原因的描述不正确的是?? ( )。
A.金属具有光泽是因为金属阳离子吸收了某些波长的可见光造成的
B.金属具有良好的导电性,是因为在金属晶体中共享了金属原子的价电子,
在外电场的作用下自由电子定向移动便形成了电流,所以金属易导电
C.金属具有良好的导热性,是因为自由电子在受热后,加快了运动速率,自
由电子通过与金属离子发生碰撞,传递了能量
D.金属晶体具有良好的延展性,是因为金属晶体中的原子层可以滑动而不破
坏金属键
参考答案:A
本题解析:金属具有金属光泽是金属中的自由电子吸收了可见光中的某些波长的光。
本题难度:简单
3、选择题 下列说法正确的是(?????????? )
A.两种元素组成的分子中一定只有极性键
B.原子晶体中共价键越强,熔点越高
C.晶体中分子间作用力越大,分子越稳定
D.由极性共价键结合的分子一定是极性分子
参考答案:B
本题解析:略
本题难度:简单
4、选择题 共价键、离子键和范德华力都是粒子之间的不同作用力,下列物质同时含有上述两种作用力的组合是( )?
①Na2O2 ②SiO2 ③石墨 ④金刚石 ⑤NaCl ⑥白磷?
A.①②④
B.①③⑥
C.②④⑥
D.③④⑤?
参考答案:B?
本题解析:Na2O2中Na+与O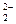 之间以离子键结合,O 之间以离子键结合,O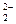 中O—O以共价键结合,符合条件;石墨中每一层内以碳碳键结合,层与层之间以 中O—O以共价键结合,符合条件;石墨中每一层内以碳碳键结合,层与层之间以
本题难度:一般
5、选择题 下列说法正确的是(??)  
A.分子晶体中分子间作用力越大,分子越稳定
B.氯化钠熔化时离子键未被破坏
C.含有阳离子的晶体中一定有阴离子
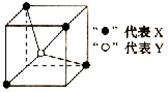
D.1 mol二氧化硅晶体含4 mol Si—O键
参考答案:D
本题解析:略
本题难度:简单
|