时间:2017-02-02 06:55:03
1、填空题 (12分)(1)现有73g某双原子分子气体,它的摩尔质量为36.5 g·mol—1。则:
① 该气体的物质的量为 mol。
② 该气体所含原子数为 NA。
③ 该气体在标况下的体积为 L。
④该气体完全溶于500mL水后稀释到2L,物质的量浓度为 mol·L—1。
(2)将100mL 0.5mol/L Na2SO4溶液加水稀释到500mL,稀释后:c(Na+)= mol·L—1。
(3) g H2O中的O原子数目与标准状况下2.24LCO2中的O原子数目相同。
参考答案:(1)①2 ②4 ③44.8
本题解析:考查有关物质的量的计算。
(1)①根据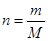 可知,m=73g÷36.5g/mol=2.0mol。
可知,m=73g÷36.5g/mol=2.0mol。
②因为是双原子分子气体,所以含有的原子是4mol。根据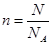 可知,原子数目是4NA。
可知,原子数目是4NA。
③根据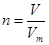 可知,气体在标况下的体积V=2.0mol×22.4L/mol=44.8L。
可知,气体在标况下的体积V=2.0mol×22.4L/mol=44.8L。
④根据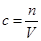 可知,稀释后的浓度是2.0mol÷2L=1.0mol/L。
可知,稀释后的浓度是2.0mol÷2L=1.0mol/L。
(2)由于稀释过程中溶质的浓度是不变的,所以稀释后溶液的浓度是0.5mol/L÷5=0.1mol/L.根据硫酸钠的化学式Na2SO4可知,稀释后c(Na+)=0.1mol/L×2=0.2mol/L。
(3)标准状况下2.24LCO2的物质的量是0.1mol,所以氧原子的物质的量是0.2mol,因此水的物质的量是0.2mol,其质量是m=n·M=0.2mol×18g/mol=3.6g。
本题难度:一般
2、选择题 下列说法中,正确的是
A.常温常压下,活泼金属与盐酸反应置换生成1摩H2,发生转移的电子数为1NA
B.22.4 L氢气中,一定含有2 mol氢原子
C.在常温常压下,28g CO和N2的混合气体中含有的分子数为1NA
D.80gNaOH溶解在1 L水中,得到溶液的物质的量浓度为2mol/L
参考答案:C
本题解析:A不正确,应该是2mol电子;B不正确,因为不一定是在标准状况下;CO和氮气的摩尔质量相同,都是28g/mol,所以C中混合气是1mol,C正确;D不正确,溶液的体积不是1L,答案选C。
本题难度:一般
3、选择题 以NA表示阿佛加德罗常数,下列说法中正确的是:(??)
A.标准状况下,22.4L苯含有NA个苯分子
B.0.2 mol·L-1 FeCl3溶液中含有Cl-总数为0.6NA
C.在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气
D.4g氦气所含分子数为NA
参考答案:D
本题解析:
试题分析:A、标准状况下,苯是液态;B、没告诉体积,不能计算;C、浓盐酸会挥发,并且随着反应的进行浓盐酸浓度减小,不会再被氧化;D、正确。
本题难度:一般
4、填空题 把18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫酸100ml,实验操作如下,
1、将配好的稀硫酸倒入试剂瓶中,贴好标签;
2、盖好容量瓶塞,反复颠倒摇匀;
3、用量筒量取___________ml的18.0mol·L-1的浓硫酸;
4、将___________沿烧杯内壁慢慢注入盛有少量___________的烧杯中;
5、用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
6、将已冷却至室温的硫酸溶液沿玻璃棒注入___________;
7、改用胶头滴管逐滴加蒸馏水,至____________________________;
8、继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处;
(1)将上述步骤按正确的顺序排列_____________________
(2)填写上述步骤中的有关空格。
参考答案:(1)3、4、6、5、7、8、2、1
(2)11.1;
本题解析:
本题难度:一般
5、选择题 某同学在配制500mL 0.5mol /LNaCl溶液的实验过程中,除用到天平、玻璃棒、烧杯、量筒、胶头滴管、试剂瓶之外,还需要的主要仪器有
A.酒精灯
B.蒸发皿
C.500mL容量瓶
D.温度计
参考答案:C
本题解析:
试题分析:一定物质的量浓度的溶液的配制一定要用到容量瓶,选C。
考点:一定浓度溶液配制的实验仪器。
本题难度:一般