时间:2017-02-02 06:53:26
1、选择题 下列说法正确的是(??? )
A.氯化氢易溶于水,难溶于汽油
B.白磷具有四面体型结构,所以它是原子晶体
C.分子晶体中分子间作用力越大,其化学性质越稳定
D.金属的导电性、导热性、延展性均与自由电子有关
2、选择题 下列说法中不正确的是
A.在金刚石晶体最小的碳原子环上有6个碳原子
B.在氯化铯晶体中每一个Cs+周围与其等距离且最近的Cl-有8个
C.在氯化钠晶体中每一个Na+周围与其等距离且最近的Na+有12个
D.水是一种非常稳定的化合物,这是由于水分子间能形成氢键的缘故
3、选择题 离子键的强弱主要决定于离子的半径和离子电荷值。一般规律是:离子半径越小,离子电荷值越大,则离子键越强。K2O、MgO、CaO三种物质中离子键由强到弱的顺序是???????????????????????????????(???)
A.K2O、MgO、CaO
B.MgO、K2O、CaO
C.MgO、CaO、K2O
D.CaO、MgO、K2O
4、选择题 硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。硅氧四面体可以用投影图表示成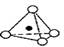 ,其中O表示氧原子,中心黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成各种不同的多聚硅酸根离子。下图为某无限长单链的多聚硅酸根离子:
,其中O表示氧原子,中心黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成各种不同的多聚硅酸根离子。下图为某无限长单链的多聚硅酸根离子: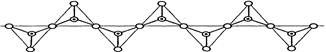
试确定该阴离子中硅原子与氧原子的个数之比为
A.1︰2
B.1︰3
C.1︰4
D.2︰5
5、选择题 近年来用红外激光技术研究液氢,发现分子间作用力也可引起粒子间的反应。在液氧中有氢分子和质子形成的H3+,其构型是等边三角形,属于二电子三中心离子,同时H3+可进步形成Hn+,下列判断正确的是[???? ]
A. H3+的电子式是
B.?H3+可在液氢中形成H4+、H5+、H6+
C. H3+可在液氢中形成H5+、H7+、H9+
D. H3+可广泛存在于固态、液态和气态中