时间:2017-02-02 06:44:14
1、简答题 硫酸钙是一种用途非常广泛的产品.
(1)25℃时,Ksp(CaSO4)=7.10×10-5.在1L0.1mol?L-1CaCl2溶液中加入1L0.2mol?L-1的Na2SO4溶液,充分反应后(假设混合后溶液的体积变化忽略不计)溶液中Ca2+物质的量的浓度为______mol?L-1.
(2)某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4?yH2O),做如下实验:将固体放在坩埚中加热,经测量剩余固体质量随时间变化如图所示.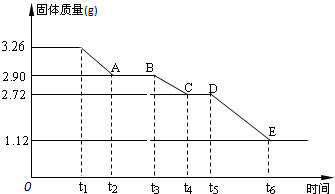
①x:y=______.
②t2~t3时间段固体的化学式为______.
③t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色,则该时间段所发生反应的化学方程式为______.
2、填空题 某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀,从而将其除去的可能性,查得如下资料:(以下数据和实验均指在25℃下测定)
| 难溶电解质 | CaCO3 | CaSO4 |
| Ksp(mol2·L-2) | 3×10-9 | 9×10-6 ? 实验步骤如下: ①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。 ②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液. ③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液. ④向沉淀中加入足量的盐酸。 (1)步骤①所得悬浊液中[Ca2+]=________ mol·L-1 (2)写出第②步发生反应的离子方程式:________________________________. (3)设计第③步的目的是________________________________________________. (4)第④步操作发生的现象为:??????????????????????????????????????????????。 3、选择题 已知:⑴混合硫酸铜溶液与碳酸钠溶液: 4、选择题 下列说法正确的是(????) 5、选择题 已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18mol2·L-2;CuS:Ksp=1.3×10-36mol2·L-2。 下列说法正确的是 |