时间:2017-02-02 05:53:32
1、计算题 (8分)在50 mL a mol/L的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO)=3 mol/L。
(1)求稀释后的溶液c(H+)= ???????????。
(2)若a=9,则生成的气体中NO2的物质的量为??????mol。?
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入1 mol/L的NaOH恰好被吸收,NaOH溶液的体积为??????????mL。
参考答案:(1)1??(2)0.125???(3)150
本题解析:
试题分析:(1)溶液中除了有H+、NO3-还有Cu2+,根据电荷守恒可知c(H+)+2c(Cu2+)= c(NO3-),所以c(H+)= 3-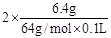 =1mol/L。
=1mol/L。
本题难度:一般
2、选择题 设NA表示阿伏加德罗常数的值,下列说法正确的是
A.5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA
B.22.4L SO2含有NA个SO2分子
C.1.6g CH4所含的电子数为NA
D.标况下,4.48L的水中含有H2O分子的数目为0.2NA
参考答案:C
本题解析:
试题分析:A.5.6 g Fe即0.1mol铁和足量的盐酸完全反应失去电子数为0.2NA,A错误;B.22.4L SO2的物质的量不一定是1mol,因为不能确定其所处的状态,则不一定含有NA个SO2分子,B错误;C.1.6g CH4的物质的量是0.1mol,所含的电子数为NA,C正确;D.标况下水不是气态,不能适用于气体摩尔体积,D错误,答案选C。
考点:考查阿伏伽德罗常数的计算
本题难度:一般
3、选择题 设NA为阿伏加德罗常数,下列叙述中正确的是(?)
A.标准状况下,1.12L的SO3所含的原子数约为0.2NA
B.1 mol Na2O2中所含的阴离子数约为2NA
C.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
D.1L0.1mol·L-1Na2CO3溶液中含有0.1NA个CO32—
参考答案:C
本题解析:标准状况下,三氧化硫不是气体,不能适用于气体摩尔体积,A不正确;过氧化钠中阳离子和阴离子的个数之比是2︰1,所以选项B中所含的阴离子数约为NA;S2和S8都是S元数的不同单质,6.4g混合物中含有0.2molS原子,C正确;碳酸钠在溶液中CO32-水解,所以D中含有的CO32—个数小于0.1NA,D不正确,答案选C。
本题难度:一般
4、选择题 下列溶液中的氯离子数目与50 mL 1 mol·L-1的FeCl3溶液中氯离子数目相等的是
A.50 mL 1.5 mol·L-1的FeCl2溶液
B.100 mL 3 mol·L-1的NH4Cl溶液
C.75 mL 3 mol·L-1的KCl溶液
D.50 mL 2 mol·L-1的CaCl2溶液
参考答案:A
本题解析:氯离子数目相等即氯离子的物质的量相等,50 mL 1 mol·L-1的FeCl3溶液的物质的量为0.05 mol,氯离子物质的量为0.15 mol,所以
50 mL 1.5 mol·L-1的FeCl2溶液物质的量为0.075 mol,氯离子物质的量为0.15 mol;
100 mL 3 mol·L-1的NH4Cl溶液中氯离子的物质的量为0.3 mol;
75 mL 3 mol·L-1的KCl溶液氯离子的物质的量为0.225 mol;
50 mL 2 mol·L-1的CaCl2溶液氯
本题难度:一般
5、选择题 某元素的一种同位素X的原子质量数为A,含N个中子,它与11H原子组成HmX分子,在agHmX中所含质子的物质的量是????[???? ]
A、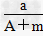 (A-N+m)mol
(A-N+m)mol
B、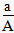 (A-N)mol
(A-N)mol
C、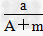 (A-N)mol
(A-N)mol
D、(A-N+m)mol
参考答案:A
本题解析:
本题难度:一般