时间:2017-02-02 05:25:49
1、选择题 在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是( )
A.图中五点Kw间的关系:B>C>A=D=E
B.C点一定是纯水
C.D点可能是醋酸溶液,E点可能是醋酸钠溶液
D.100℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性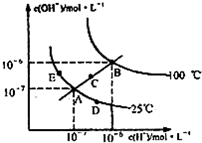
参考答案:B
本题解析:
本题难度:简单
2、选择题 已知25℃时有关弱酸的电离平衡常数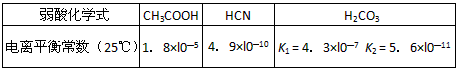
现维持25℃,下列有关说法正确的是[???? ]
A.NaHCO3溶液中:c(OH-)-c(H+) =c(H2CO3)-c(CO32-)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.等物质的量浓度的各溶液pH关系为:pH(NaHCO3)>pH(NaCN)>pH(CH3COONa)
参考答案:A
本题解析:
本题难度:一般
3、选择题 在0.1mol/L的氨水中存在 NH3·H2O  ?NH4++OH-的电离平衡,下列措施都能使该平衡向右移动的一组是 (?? )
?NH4++OH-的电离平衡,下列措施都能使该平衡向右移动的一组是 (?? )
①加入少量HCl? ②加入固体NaOH?? ③加水??? ④通入氨气
⑤加热升高温度?? ⑥加入NH4NO3
A.①③④⑤
B.①③④⑤⑥
C.②③④⑤
D.①③④⑥
参考答案:A
本题解析:
试题分析:向氨水中加入盐酸,H+与OH-反应,平衡向右移动;加氢氧化钠固体,c(OH-)增大,平衡向左移动;加水稀释,促进电离,平衡向右移动;通入氨气,c(NH3·H2O)增大,平衡向右移动;电离过程是吸热过程,升高温度,平衡向右移动;加入硝酸铵,c(NH4+)增大,平衡向左移动。
点评:勒沙特列原理同样适用于弱电解质电离平衡。
本题难度:一般
4、选择题 下列叙述正确的是( )
A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
B.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
C.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
D.0.1mol?L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:A、pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中
本题解析:
本题难度:一般
5、选择题 水的电离过程为H2O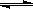 H++OH-,在25℃时水的离子积为:KW=1.0×10-14,在35℃时水的离子积为:KW=2.1×10-14,则下列叙述正确的是 ( )
H++OH-,在25℃时水的离子积为:KW=1.0×10-14,在35℃时水的离子积为:KW=2.1×10-14,则下列叙述正确的是 ( )
A.水的电离是个吸热过程
B.35℃时c(H+)<c(OH-)
C.c(H+)随着温度的升高而降低
D.35℃时的水比25℃时的水电离程度小
参考答案:A
本题解析:略
本题难度:简单