时间:2017-02-02 05:23:13
1、选择题 某温度下,pH相同的盐酸和氯化铵溶液分别稀释,pH随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是
A.Ⅰ为氯化铵稀释时pH值变化曲线,Ⅱ为盐酸稀释时pH值变化曲线
B.b点溶液中水的电离程度比d点溶液中水的电离程度大,但两点的KW相同
C.a点时,等体积的两溶液分别与NaOH反应,消耗的NaOH量相同
D.c点溶液的导电能力一定比b点溶液导电能力强
参考答案:D
本题解析:
试题分析:A、盐酸为强酸,氢离子完全电离。氯化铵水解得到氢离子,加水稀释的同时水解程度增大,氢离子浓度减小的同时有所增加,所以变化较小,Ⅰ为盐酸稀释时pH值变化曲线,Ⅱ为氯化铵稀释时pH值变化曲线,故A错;B、b、d两点pH均小于7,b点溶液中氢离子浓度大,对水的电离抑制作用强,所以b点水的电离程度比d点溶液中水的电离程度小,错误;C、pH相同的盐酸和氯化铵,氯化铵浓度大,等体积的两溶液氯化铵消耗的氢氧化钠多,错误;D、C点离子浓度大,导电能力强,正确。
本题难度:一般
2、填空题 已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c (Ca2+)________,原因是____???______________(用文字和离子方程式说明)。
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______________________。若某CuSO4溶液中c (Cu2+)=0.02 mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于________(已知Ksp[Cu(OH)2]=2.0×10-20)。
(3)常温下,向某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈________性。在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液时所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中电离出的CO32-水解所致,请你设计一个简单的实验方案给甲和乙两位同学的说法进行评判(包括简要操作、现象和结论)_________________ ___________。
参考答案:(1)①增大;②增大, 加盐酸发生反应:A2-+H+ 本题解析: 3、选择题 将PH=3的某酸溶液和PH=11的某碱溶液等体积混合溶液的PH 参考答案:D 本题解析:略 本题难度:简单 4、选择题 下列各式中属盐的水解反应的是( ) 参考答案:B 本题解析:略 本题难度:简单 5、选择题 在一定条件下,Na2CO3溶液中存在CO32-+H2O 参考答案:A 本题解析: 本题难度:一般
试题分析:(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)? ?Ca2+(aq)+A2-(aq) ΔH > 0。①该反应为吸热反应,温度升高,平衡正向移动,Ksp增大;②根据化学平衡移动原理,滴加少量浓盐酸,发生反应:A2-+H+
?Ca2+(aq)+A2-(aq) ΔH > 0。①该反应为吸热反应,温度升高,平衡正向移动,Ksp增大;②根据化学平衡移动原理,滴加少量浓盐酸,发生反应:A2-+H+本题难度:一般
A.大于7
B.小于7
C.等于7
D.无法确定
A.


B.


C. =
=
D.
 HCO3-+OH-平衡。下列说法不正确的是( )
HCO3-+OH-平衡。下列说法不正确的是( )
A.稀释溶液,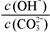 减小
减小
B.加入NaOH固体,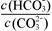 减小
减小
C.升高温度,平衡常数增大
D.通入CO2,溶液pH减小
试题分析:A.稀释后C(OH-)、C(CO32-)都减小,但平衡正向移动使的C(OH-)又有所增加,C(CO32-)又有所减小。因此C(OH-)减小的少,C(CO32-)减少的多,故 增大。错误,符合题意。B.加入NaOH固体,平衡逆向移动,C(HCO3-)减小,C(CO32-)增大,所以
增大。错误,符合题意。B.加入NaOH固体,平衡逆向移动,C(HCO3-)减小,C(CO32-)增大,所以