时间:2017-02-02 05:22:53
1、选择题 铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到氢气2bg,且向反应后的溶液中加人KSCN溶液,不显红色,则原混合物中氧化铁的物质的量为
A. ??? B (a — b) mol
??? B (a — b) mol
C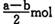 ???D. (a+b) mol
???D. (a+b) mol
参考答案:C
本题解析:本题铁及化合物的计算。根据题意知:Fe和Fe2O3的混合物与盐酸反应再加入KSCN不显红色,这说明无Fe3+,且放出H2 bmol。所发生的反应方程式为: Fe2O3+6HCl 2FeCl3+3H2O①Fe+2HCl
2FeCl3+3H2O①Fe+2HCl本题难度:一般
2、实验题 人教版《必修1》关于Fe3+和Fe2+的转化的实验探究,某校教师为了检验学生完成每个实验过程时相应的问题解决思路,特设计一份化学探究学习“过程-思路”问卷。
(1)请在下表中右栏填写设计每一步操作过程的思路
| 过程 | 思路 | |||||||||||||||
| 1.提出假设:Fe2+具有还原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被还原成Fe2+ | ①根据氧化还原反应原理,一般?????物质有还原性,????????物质有氧化性 | |||||||||||||||
| 2.设计实验1:取少量FeCl2溶液,滴加几滴H2O2溶液,再向溶液中滴加几滴KSCN溶液,观察溶液是否变血红色 | ②用离子方程式表示选择H2O2的原因????? ③用离子方程式表示溶液变血红色的原因??? | |||||||||||||||
| 3.设计实验2:取少量FeCl3固体于一试管,用已煮沸的蒸馏水溶解,滴加几滴KSCN溶液后迅速加入少量铁粉,盖上试管塞,观察溶液的血红色是否褪去 | ④选择铁粉的原因是??????????(用化学方程式表示) ⑤为什么要用煮沸的水????????????????? | |||||||||||||||
| 4.实施实验 | …… | |||||||||||||||
| …… | …… ? (2)教材中实验方案如下:取2mLFeCl3溶液,加入少量铁粉,充分反应后,滴入几滴KSCN溶液,观察并记录实验现象。把上层清液倒入另一试管中,再滴入几滴氯水,又发生了什么变化?学生通过实践证明,实验效果很差:没有预期的红色出现,而是很淡的浅红色,试分析实验中出现异常的可能原因并加以改进使实验现象更明显。 ⑥可能的原因:???????????????????????????????????????????????????????????? ⑦改进措施:?????????????????????????????????????????????????????????????? 参考答案: 本题解析:实验探究题(1)①根据所给出的离子,从化合价的角度分析氧化还原性,低价物质具有还原性,高价物质具有氧化性;②加入双氧水具有氧化性把Fe2+氧化成Fe3+④铁粉用来还原Fe3+转化为Fe2+;⑤除去溶液中溶解的气体一般采用加热的方法,因为温度高气体溶解度降低;(2)溶液颜色没有出现红色,原因可能是Fe3+ 和SCN-缺少一种,溶液中氯水能氧化出Fe3+ ?,所以结果只有一种可能就是SCN-被氧化。为了避免SCN-氧化,应先加入氯水后,在加入KSCN溶液,具体操作应为取适量FeCl3溶液,加入足量铁粉,然后将 本题难度:一般 3、选择题 将5.6g铁溶于足量稀盐酸中,再加入足量的氢氧化钠溶液,充分反应,过滤;在空气中加热所得滤渣,灼烧到质量不再变化,此时固体的质量为 参考答案:B 本题解析: 本题难度:一般 4、选择题 下列关于铁及其化合物的说法中正确的是 参考答案:C 本题解析: 本题难度:一般 5、填空题 目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。?
|