时间:2017-02-02 05:22:14
1、填空题 常温下,将20.0?g?14%的NaCl溶液跟30.0?g?24%的NaCl溶液混合,混合后得到密度为1.17?g/cm3的溶液。请计算:
(1)混合后溶液中NaCl的质量分数为________。
(2)混合后溶液中NaCl的物质的量浓度为________。
(3)在1?000?g水中需加入________mol?NaCl,才能使其浓度恰好与上述混合后溶液的浓度相等。(假设密度不变,计算结果保留1位小数)
参考答案:(1)20%
(2)4.0 mol/L
(3)4
本题解析:
本题难度:一般
2、选择题 在100g浓度为18mol/L、密度为ρ(g/cm3)的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入水的体积(??)
A.小于100mL
B.等于100mL
C.大于100mL
D.等于100/ρ mL
参考答案:A
本题解析:硫酸的密度等于水的,根据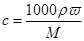 可知,当硫酸的浓度稀释成9mol/L时,溶液的质量分数大于原来的1/2,所以加入的水的质量小于100g,则体积小于100ml,答案选A。
可知,当硫酸的浓度稀释成9mol/L时,溶液的质量分数大于原来的1/2,所以加入的水的质量小于100g,则体积小于100ml,答案选A。
本题难度:一般
3、选择题 设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.0.5 L 1 mol/L NaHS溶液中,N(Na+)+N(HS—)=NA
B.12.4 g白磷(分子式为P4)中含有P—P共价键0.6 NA
C.常温下,pH=2的醋酸溶液中所含有的H+数为0.01 NA
D.将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体分子数为NA
参考答案:B
本题解析:
试题分析:A、在0.5mol的NaHS中Na+和HS-的个数共1mol,但在溶液中HS-离子会发生电离和水解,故HS-的个数减少,N(Na+)+N(HS)的总数小于NA,故A错误;B、白磷是正四面体结构,一个白磷分子中含6条P-P键,白磷0.1mol,故P-P键的数目为0.6NA,故B正确;C、没溶液的体积,不能求出溶液中氢离子的个数,故C错误;D、在容器中存在N2O4=2NO2的可逆反应,故放入容器中因发生该反应而使气体分子数增多,故D错误;故选B。
考点:微粒数目的计算。
本题难度:一般
4、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是???????????
A.0.1mol·L-1氢氧化钠溶液中含钠离子数为0.1NA
B.7gCnH2n中含氢原子数为NA
C.1mol C5?H12分子中共价键总数为13NA
D.标准状况下,2.24L NH3和CH4的混合气体,所含电子总数为2NA
参考答案:B
本题解析:略
本题难度:简单
5、选择题 三种正盐的混合溶液中含有0.2 mol Na+,0.25 mol Mg2+,0.4 mol Cl-,则SO42-为 [???? ]
A、0.1 mol
B、0.3 mol
C、0.5 mol
D、0.15 mol
参考答案:D
本题解析:
本题难度:简单