时间:2017-02-02 05:17:21
1、选择题 工业上接触法制硫酸的生产过程中,下列措施有利于提高SO2的转化率的是( )
①V2O5作催化剂 ②通入过量O2 ③两次氧化④SO2、O2循环使用 ⑤通过热交换器进行热交换⑥通入过量SO2
A.①②③
B.②③④⑤
C.②③④⑤⑥
D.全部
参考答案:B
本题解析:使用催化剂只能提高反应速率而不影响平衡移动;通入过量的O2可使平衡右移,提高SO2的转化率;两次氧化和SO2、O2循环使用均能使未转化的SO2进一步转化为SO3;SO2的氧化正反应为放热反应,而热交换器可以使反应后混合气体温度降低,使平衡右移;通入过量的SO2,虽然能使化学平衡右移,但由于SO2的量增加而使SO2的转化率降低。因此能提高SO2的转化率的措施为②③④⑤。
本题难度:简单
2、选择题 “绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是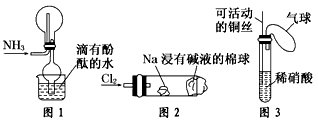 [???? ]
[???? ]
①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A.②③④
B.①②③
C.①②④
D.①③④
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列哪种工业生产的过程不必使用电解的方法( )
A.由光卤石制镁
B.由黄铁矿制硫酸
C.由铝土矿制铝
D.由海水制氢氧化钠
参考答案:B?
本题解析:A项MgCl2 Mg+Cl2↑?
Mg+Cl2↑?
C项2Al2O3 4Al+3O2↑
4Al+3O2↑
D项2NaCl+2H2O
本题难度:简单
4、填空题 抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图: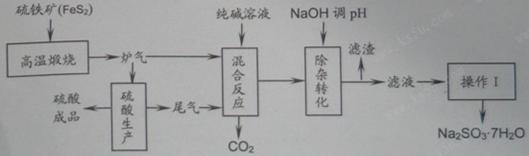
已知:①炉气、尾气中含有SO2;②混合反应中还溶解有少量Fe2O3、MgO等矿尘。
(1)煅烧1molFeS2放出热量为853kJ,则FeS2燃烧的热化学方程式为_____________。
(2)“混合反应”中纯碱(Na2CO3)参与反应的化学方程式为_____________(任写一个)。
(3)用NaOH“除杂”时,主要的离子方程式为_____________(任写一个)。
(4)通过“操作Ⅰ”可以得到亚硫酸钠晶体,写出主要操作步骤的名称:__________。
(3)硫酸生产中炉气转化反应为:2SO2(g)+ O2(g) 2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________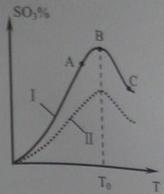
A.该反应的正反应为放热反应
B.曲线Ⅰ上A、C两点反应速率的关系是: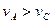
C.反应达到B点时,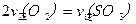
D.已知V2O5的催化效果比Fe2O3好,若Ⅰ表示用V2O5催化剂的曲线,则Ⅱ是Fe2O3作催化剂的曲线
参考答案:(1)4FeS2(S)+11O2(g)=8SO2(g)+2F
本题解析:略
本题难度:简单
5、选择题 工业上用二氧化锰制备高锰酸钾可分两步进行。
(1)二氧化锰与氢氧化钾共熔,并通入氧气: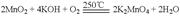 ;
;
(2)电解锰酸钾溶液: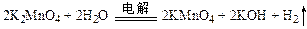 ?。
?。
下列说法正确的是
A.上述物质中,氧化性:KMnO4> K2MnO4 >O2
B.上述过程中,每生成1 mol KMnO4需转移6 mol 电子
C.电解时,KMnO4在阳极区生成
D.电解时,阴极周围pH减小
参考答案:C
本题解析:略
本题难度:简单