时间:2017-02-02 05:14:25
1、填空题 以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钾和氧化铁红颜料,原料的综合利用率较高。其主要流程如下: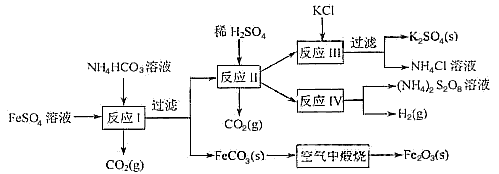
(1)反应Ⅰ前需在FeSO4溶液中加入_____(填字母),以除去溶液中的Fe3+
A.锌粉
B.铁屑
C.KI溶液
D.H2
(2)反应Ⅰ需控制反应温度低于35℃,其目的是_______________。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是_________________。
(4)反应Ⅳ常被用于电解生产 (NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为________________。
参考答案:(1)B
(2)防止NH4HCO3分解(或减少Fe2
本题解析:
本题难度:一般
2、填空题 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下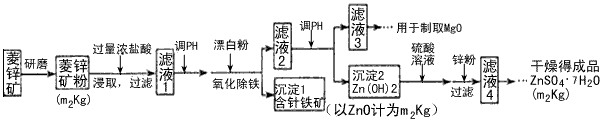
(1)将菱锌矿研磨成粉的目的是__________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
____Fe(OH)2+_______+_____=_______Fe(OH)3 +________Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为
89,化学式是_______。
(4)根据下表数据,调节滤液2的pH时,理论上可选用的最大区间为_______________。 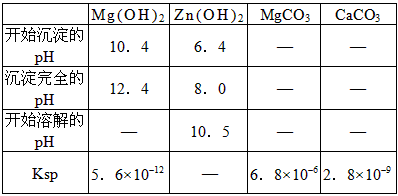
(5)工业上从滤液3制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)滤液4之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
参考答案:(1)增大反应物接触面积(或增大反应速率或使反应更充分) 本题解析: 本题难度:困难 3、填空题 硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红 等产品的流程如下图所示 参考答案:(1)C 本题解析: 本题难度:一般 4、填空题 工业上制备BaCl2的工艺流程图如下:?? 参考答案:⑴S2-?+?H2O? 本题难度:一般 5、填空题 稀土元素是周期表中ⅢB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下 参考答案:(1)Y2O3·FeO·2BeO·2SiO2 本题解析: 本题难度:一般
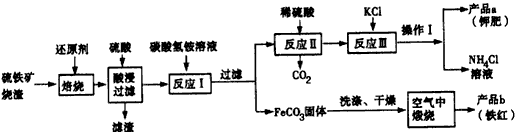
已知几种盐的溶解度随温度变化的曲线如下图所示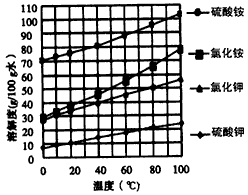
回答下列问题:
(1)硫铁矿烧渣焙烧时所添加的还原剂最有可能的是________ (填字母)。
A.铝 B.镁 C.碳 D.氢气
(2)反应I的反应温度一般需控制在35℃以下,其目的是____________________。
(3)写出反应Ⅲ的离子方程式___________________,操作I是____________。
(4)空气中煅烧FeCO3生成产品b的化学反应方程式为___________________。
(5)检验产品a中是否含有氯化物杂质的实验操作是:取少量产品a于试管中配成溶液,____________。
(2)防止NH4HCO3分解(或减少Fe2
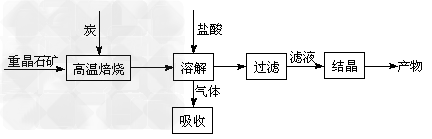
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)?+?4C(s)? 4CO(g)?+?BaS(s)???△H1?=+?571.2?kJ·mol-1?????①
4CO(g)?+?BaS(s)???△H1?=+?571.2?kJ·mol-1?????①
BaSO4(s)?+?2C(s)? 2CO2(g)?+?BaS(s)???△H2=?+226.2?kJ·mol-1?????②
2CO2(g)?+?BaS(s)???△H2=?+226.2?kJ·mol-1?????②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为____________。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,?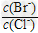 =?_________。?
=?_________。?
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s)?+?CO2(g)? 2CO(g)的△H2=___________?kJ·mol-1。
2CO(g)的△H2=___________?kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是_________,__________。
本题解析:
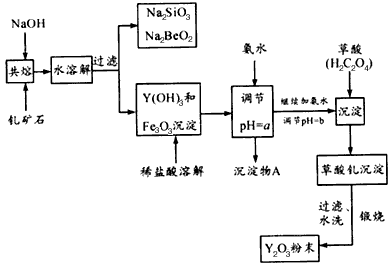
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表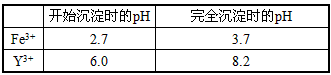
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为_______________。
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则①最好选用盐酸、____(填字母)两种试剂,再通过必要的操作即可实现。
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式: ______________________。
(3)为使Fe3+沉淀完全,须用氨水调节pH =a,则a应控制在_________的范围内;检验Fe3+是否沉淀完全的操作方法是_______________________
(2)①