时间:2017-01-24 20:43:00
1、计算题 (6分)2005年国家质检总局铝合金抽检合格率约为90%。已知国家行业标准中铸造铝合金的各成分的质量分数为:Si—4.5%—5.5%,Cu—1.0%—1.5%,Mg—0.4%—0.6%,其余为Al。
现对某品牌的铸造铝合金中所含的四种成分作如下的实验检测:
①称取18.0 g铸造铝合金样品,分成等质量的A、B两份。向A份加入足量NaOH溶液,B份加入足量的稀盐酸。(已知:Si+2NaOH+H2O====Na2SiO3+2H2↑)
②待两份反应物都充分反应之后,称得滤渣质量相差0.512 g,收集得到的两份气体的体积相差851.2 mL(标准状况下)。
试完成下列问题:
(1)样品中Si和Mg的物质的量分别是多少?
(2)通过计算判断该品牌的铸造铝合金是否为合格产品。
参考答案:(1)0.02 mol? 0.002 mol
(2)不
本题解析:(1)设9 g样品中所含Si的物质的量为x,Mg的物质的量为y。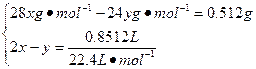
解得:x="0.02" mol,y="0.002" mol
(2)因为合金中Si的百分含量为:0.02 mol×28 g·mol-1÷9 g×100%=6.2%,超过国家标准,故该铸造铝合金属于不合格产品。
本题难度:一般
2、选择题 两分铝屑,一份与过量盐酸反应,另一份与过量NaOH溶液反应,产生的H2体积比为1:2,则两份铝屑的质量比为
A.1:1
B.1:2
C.1:3
D.2:1
参考答案:B
本题解析:
试题分析:盐酸与氢氧化钠溶液是过量的,因此反应中铝 完全溶解。在反应中铝均是失去3个电子,所以根据电子守恒并依据产生的H2体积比为1:2可知,两份铝屑的质量比为1:2,答案选B。
本题难度:一般
3、简答题 某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡.触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性.若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化.
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是______.
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择:______.
(2)铝片表面出现的暗红色物质的过程中发生的离子反应方程式是______.?用离子方程式解释产生气泡的原因:______.
(3)放出的气体是______,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是______.(写出一点即可)
(4)某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是______.
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
(5)除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 A 正极 NaOH Al-3e-=Al3+ 2H2O+2e-=2OH-+H2↑ B 负极 稀盐酸 2Al-6e-=2Al3+ 6H++6e-=3H2↑ C 正极 浓硝酸 Cu-2e--=Cu2+ 2NO3-+4H+-4e-=2NO2↑+2H2O D 负极 稀硝酸 Cu-2e-=Cu2+ 2NO3-+8H+=2NO↑+4H2O+6e- 其中正确的是______,由此推知,金属作电极不仅与本身性质相关,而且与______有关. 参考答案:(1)金属铝的表面有一层致密的氧化物薄膜,氯化铝和硫酸铝阴离 本题解析: 本题难度:一般 4、选择题 下列有关金属的说法中,不正确的是( ) 参考答案:A.青铜中含有锡,不锈钢中含有铬和镍,硬铝是铝、铜、镁、硅的 本题解析: 本题难度:一般 5、选择题 Al(OH)3和Mg(OH)2的分解温度是200~300℃和340~ 490℃,与聚乙烯的分解温度比较接近,将上述两种氢氧化物添加于聚乙烯制品中可以起阻燃作用的原理解释不正确的是?? [???? ] 参考答案:D 本题解析: 本题难度:简单 |