1、选择题 某温度下 ,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示,据图分析,下列判断错误的是( )
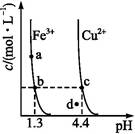
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
参考答案:B
本题解析:b、c两点金属阳离子的浓度相等,都设为x,设该温度为室温,则c(OH-)c=10-9.6 mol·L-1,c(OH-)b=10-12.7 mol·L-1,则Ksp[Fe(OH)3]=x×(10-12.7)3,Ksp[Cu(OH)2]=x×(10-9.6)2,故Ksp[Fe(OH)3]<Ksp[Cu(OH)2],A正确;a点到b点的碱性增强,而NH4Cl溶解于水后显酸性,故B错
本题难度:一般
2、填空题 (1)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分
搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=???????mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
(2)若在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是???????mol·L-1。
参考答案:(1)2.2×10-8 (2)0.2
本题解析:(1)根据溶度积的概念可以直接计算。pH=8时,c(OH-)=10-6 mol·L-1,由c(Cu2+)·c2(OH-)=Ksp[Cu(OH)2]可得,c(Cu2+)=(2.2×10-20)/10-12 mol·L-1=2.2×10-8 mol·L-1。(2)在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,溶液中溶质为硫酸,c(SO42-)不变,为0.1 mol·L-1,c(H+)为0.2 mol·L-1。
本题难度:一般
3、选择题 查阅资料得知Fe3+、Mg2+、Al3+在浓度均为0.1mol?L-1时,氢氧化物沉淀的pH如下表:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3
开始沉淀的pH
2.3
10.8
3.7
开始溶解的pH:7.8
完全沉淀的pH
4.3
12.4
5.2
完全溶解的pH:10.0
若要从含Fe3+、Mg2+、Al3+的混合溶液中,只得到Fe(OH)3沉淀,则应调节溶液的pH( )
A.12.4~14
B.7.8~10.0
C.10.0~10.8
D.3.7~5.2
参考答案:若要从含Fe3+、Mg2+、Al3+的混合溶液中,只得到Fe
本题解析:
本题难度:一般
4、填空题 (8分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:

(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH
| < 8.0
| 8.0 ~ 9.6
| > 9.6
| 颜色
| 黄色
| 绿色
| 蓝色
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色
为 [25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
参考答案:(8分)
(1)2NH4+ + MgO=Mg2+ +
本题解析:
试题分析:(1)MgO与硫酸铵溶液加热反应生成的气体与硫酸反应生成硫酸铵,说明该气体是氨气,则MgO与硫酸铵加热的产物中有氨气,说明MgO的加入,促进铵根离子的水解,生成氨气,得到的氢离子与MgO反应生成镁离子和水,所以步骤②中发生反应的离子方程式为2NH4+ + MgO=Mg2+ + 2NH3↑+ H2O;
(2)得到的硫酸镁溶液中镁离子水解,得不到较纯的硫酸镁晶体所以为抑制镁离子水解,步骤④中调节pH=6.0~6.5,以便得到更多更纯的产品;
(3)由溶液得到晶体需进行的操作是蒸发浓缩、冷却结晶,所以步骤⑤的操作为蒸发浓缩,冷却结晶;
(4)饱和的氢氧化镁溶液存在Mg(OH)2 (s)= Mg2+(aq) + 2 OH-(aq)溶解平衡,2c(Mg2+)= c(OH -),又溶度积Ksp= c(Mg2+)c2(OH -)=5.6×10-12 ,由此可以得出c(OH -)=2.24×10-4 ,c(H+)=1×10-14/2.24×10-4 =4.5×10-11,所以pH>9.6,所以加入百里酚蓝指示剂,溶液呈蓝色。
考点:查了镁及其化合物性质的应用,对工业流程的分析,操作步骤的判断,溶度积的计算
本题难度:一般
5、填空题 (14分)元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩:
⑴在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。与铜相比,其金属活泼性 。(填“强”或“弱”)
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是 。
(3)工业上净化处理铬污染方法之一:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[ Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为贵重金属之一。
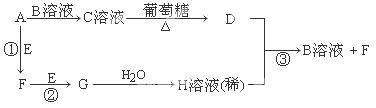
请回答下列问题:
(1)A分子是 分子(填“极性”或“非极性”),C溶液中的阳离子是 (写化学式,不考虑水的电离)。
(2)反应①的化学方程式为 ;反应③的离子方程式为 。
参考答案:Ⅰ.(1)强;(2)Cr( OH)3 本题解析: 本题解析:
试题分析:Ⅰ(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液,而铜与稀硫酸不反应,说明铬的活泼性强于铜。(2)Cr(OH)3和Al(OH)3类似,由Al(OH)3的酸式电离可知,Cr(OH)3的酸式电离方程式是:Cr(OH)3 H++CrO2-+H2O;(3)电解后溶液中c(Fe3+)=2.0×10-13mol/L,则溶液中c3(OH-)=4×10?38/2.0×10-13 =2×10-25,故溶液中c(Cr3+)=6.0×l0-31/2×10-25 =3×10-6mol/L;Ⅱ、C溶液与葡萄糖在加热条件下生成金属D,则D为Ag、C为银氨溶液,气体A与溶液B得到银氨溶液,则A为NH3、B为AgNO3,Ag与溶液H反应得到硝酸银与气体F,则H为HNO3,逆推可知G为NO2,F为NO,E为O2。(1)A为NH3,所含化学键均为极性键,空间构型为三角锥形,属于极性分子; C溶液中的阳离子为[Ag(NH3)2]+;(2)反应①的化学方程式为4NH3+5O2 H++CrO2-+H2O;(3)电解后溶液中c(Fe3+)=2.0×10-13mol/L,则溶液中c3(OH-)=4×10?38/2.0×10-13 =2×10-25,故溶液中c(Cr3+)=6.0×l0-31/2×10-25 =3×10-6mol/L;Ⅱ、C溶液与葡萄糖在加热条件下生成金属D,则D为Ag、C为银氨溶液,气体A与溶液B得到银氨溶液,则A为NH3、B为AgNO3,Ag与溶液H反应得到硝酸银与气体F,则H为HNO3,逆推可知G为NO2,F为NO,E为O2。(1)A为NH3,所含化学键均为极性键,空间构型为三角锥形,属于极性分子; C溶液中的阳离子为[Ag(NH3)2]+;(2)反应①的化学方程式为4NH3+5O2 4NO+6H2O;反应③的离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O。 4NO+6H2O;反应③的离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O。
考点:本题考查金属活泼性的判断、方程式的书写、KsP的计算、物质的推断及化学方程式的书写。
本题难度:一般
|
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G
|
