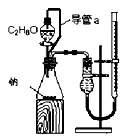
D.配制稀硫酸溶液
?
参考答案:A
本题解析:
试题分析:A、装置中左边是反应装置,右边是量气装置,正确;B、应用湿润的红色石蕊试纸或pH试纸检验氨气,错误;C、蒸馏操作中应把温度计的水银球放在蒸馏烧瓶的支管口处测定出去气体的温度,错误;D、浓硫酸溶解放出大量热,不能直接在容量瓶中稀释,错误。
本题难度:一般
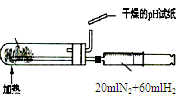
2、实验题 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。回答下列问题
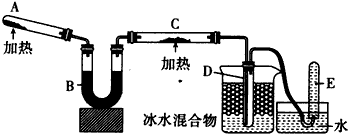
(1)A中加入的物质是_______________。发生反应的化学方程式是_______________。
(2)B中加入的物质是____________,其作用是_______________
(3)实验时在C中观察到的现象是____________,发生反应的化学方程式是___________________。
(4)实验时在D中观察到的现象是___________,D中收集到的物质是____________,检验该物质的方法和
现象是________________。
参考答案:(1)氯化铵和消石灰;2NH4Cl+Ca(OH)2![]()
本题解析:
本题难度:一般
3、实验题 (14分)碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5 mol·L-1MgSO4溶液和0.5 mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL三口烧瓶中,开启搅拌器。温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤、洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
回答下列问题:
步骤3中加氨水后的离子方程式???????????????????。
(2)测定合成的MgCO3·nH2O中的n值。称量1.000 g碳酸镁晶须,放入如图所示的广口瓶中加入水滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30 ℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
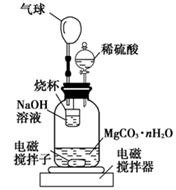 
①图中气球的作用是???????????。
②上述反应后期要升温到30℃,主要目的是???????。
③用已知浓度的盐酸滴定烧杯中的溶液时应选用???????为指示剂,若盛放盐酸的滴定管在滴定前有气泡未排尽,滴定后无气泡(其他操作均正确),则所测CO2的量会???????(填“偏大”“偏小”“无影响”)
④设3次实验测得每1.000 g碳酸镁晶须与稀硫酸反应产生的CO2平均值为a mol,则n值为???????(用含a的表达式表示)。
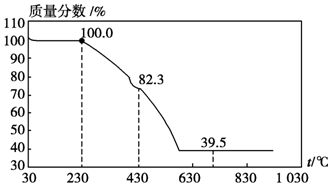
(3)称取100 g上述晶须产品进行热重分析,热重曲线如图。则该条件下合成的晶须中,n=????(选填1、2、3、4、5)。
参考答案:(1) NH3·H2O+Mg2++HCO 本题解析: 本题解析:
试题分析:(1)氨水是弱碱,与碳酸氢镁反应的离子方程式为NH3·H2O+Mg2++HCO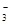 ===MgCO3↓+NH ===MgCO3↓+NH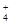 +H2O。 +H2O。
(2)①装置中气球可以暂时储存CO2,有利于CO2被NaOH溶液吸收,且能保持装置中压强相对稳定。②反应后期将温度升到30℃,使生成的二氧化碳全部逸出后被氢氧化钠溶液吸收,减少测定产生的误差。
③用盐酸滴定时,反应后溶液显酸性,因此应该选择甲基橙作指示剂。若盛放盐酸的滴定管在滴定前有气泡未排尽,滴定后无气泡(其他操作均正确),则导致消耗盐酸溶液的体积增加,从而使所测CO2的量会偏大。
④实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,依据元素守恒可知,碳酸镁物质的量为amol,根据化学式可知,MgCO3?nH2O中碳酸镁晶体中碳酸镁和结晶水物质的量之比为1:n,得到1:n=a: ;得到n=(1-84a)/18a。 ;得到n=(1-84a)/18a。
(3)MgCO3?nH2O中n=1~5,分析图象400°C剩余质量为82.3g,为失去结晶水的质量,剩余质量为39.2g是碳酸镁分解失去二氧化碳的质量,得到100g×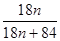 =100-82.3,n=1。 =100-82.3,n=1。
本题难度:一般
4、实验题 (10分)某活动课程小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25 mL  NaOH溶液吸收过量的CO2气体,至CO2 NaOH溶液吸收过量的CO2气体,至CO2 气体不再溶解; 气体不再溶解;
b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式_________________.
此方案第一步的实验装置如下图所示:

(2)加入反应物前,如何检验整个装置的气密性:________________________??????????________________________________________________
(3)若用大理石与盐酸制CO2,则装置B中盛放 的试剂是_____? 的试剂是_____? _,作用是_____________________________________________ _,作用是_____________________________________________
(4)在实验室通常制法中,装置A还可作为下列______????(填序号)气体的发生装置.
①HCl ②H2 ③O2 ④NH3
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为_______???????mol/L.
参考答案:(10分)(1)HCO+OH-===CO+H2O
(2
本题解析:略
本题难度:简单
5、实验题 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。

回答下列问题:
(1)A中加入的物质是___________________, 发生反应的化学方程式是______________________。
(2)B中加入的物质是___________________,其作用是_________________________。
(3)实验时在C中观察到的现象是____________________;发生反应的化学方程式是_______________。
(4)实验时在D中观察到的现象是_________________________, D中收集到的物质是_____________,检验该物质的方法和现象是__________________________________。
参考答案: (1)固体NH4Cl和Ca(OH)2;2NH4Cl+C
本题解析:
本题难度:一般
|