时间:2017-01-24 19:42:35
1、填空题 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: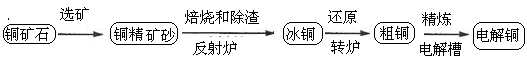
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是?????????、??????????,反射炉内生成炉渣的主要成分是??????????;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是??????????、???????????;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板是图中电极??????????(填图中的字母);在电极d上发生的电极反应式为??????????;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为?????????????。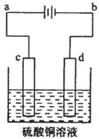
2、填空题 (16分)金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:
(2)一定温度下,氧化铁可以与一氧化碳发生如下反应: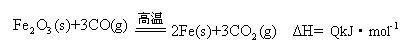
①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为?????????????;
②达平衡后,若温度升高,的值增大,则Q????0(填“>”、“=”、“<”)。
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为????????(填序号)。???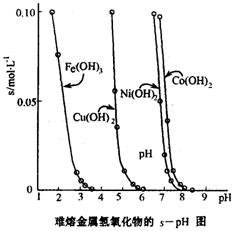
A.小于l??? B.4左右?????? C.大于6??? D.大于9
(4)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)=??????????:?????????:?????????。
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是???????(填序号)。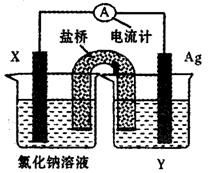
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
D.原电池工作时,x电极反应为:O2+2H2O+4e-→4OH-
3、实验题 (16分)某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,因温度不同、受热不均时会生成Fe3O4且也能被磁铁吸引。为探究X的组成,他们进行了如下实验。
Ⅰ.定性检验
| 实验编号 | 实验操作 | 实验现象 | ||||||||||||
| ① | 取少量黑色粉末X放入试管1中,注入适量稀盐酸,微热。 | 黑色粉末逐渐溶解,有无色气体逸出。 | ||||||||||||
| ② | 向试管1所得溶液中滴加几滴 KSCN溶液,振荡。 | 溶液未出现血红色 (1)由上述实验现象推断,黑色粉末X的成分中是否一定不含Fe3O4?____(填“是”或“否”)。 (2)实验①中可能发生反应的离子方程是????????,???????????,????????????。 Ⅱ.定量测定 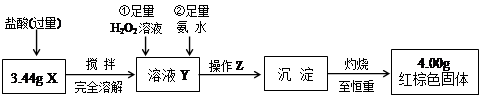 (3)操作Z是????????????????。在灼烧沉淀时必须用到的下列仪器的名称是____________________________。  (4)通过以上数据,得出3.44g黑色粉末X中各成分的物质的量为:______、______。 4、填空题 工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
|