时间:2017-01-24 19:30:28
1、选择题 有两种一元弱酸的钠盐溶液,其物质的量浓度相等,现向这两种盐的溶液中分别通入适量的CO2,发生如下反应:NaR+CO2+H2O=HR+NaHCO3 2NaR1+CO2+H2O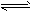 2HR1+Na2CO3;HR和HR1的酸性强弱比较,正确的是 [???? ]
2HR1+Na2CO3;HR和HR1的酸性强弱比较,正确的是 [???? ]
A.HR较弱
B.HR1较弱
C.两者相同
D.无法比较
参考答案:B
本题解析:
本题难度:一般
2、选择题 常温下,对于给定的电解质溶液,下列叙述中正确的是 [???? ]
A.体积相同、浓度均为0.1 mol/L的NaOH溶液和氨水,分别稀释m倍、n倍,溶液的pH都变成9,则
m<n
B.有甲、乙两醋酸溶液,测得甲的pH =a,乙的pH =a+1,若用于中和等物质的量浓度、等体积的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲)?
C.pH=9的NaOH溶液和NaAc溶液中,由水电离出的c(H+)均为10-5mol/L
D.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+ 2c(CO32-),该式只可能满足NaHCO3溶液中的离子浓度关系
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列物质中,最难电离出H+的是[???? ]
A.H2SO4
B.CH3COOH
C.H2O
D.CH3CH2OH
参考答案:D
本题解析:
本题难度:简单
4、选择题 在室温下,100ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH值减小,但又要使醋酸电离程度减少,应采取(?????)
A.加入少量CH3COONa固体
B.通入少量氯化氢气体
C.提高温度
D.加入少量纯醋酸
参考答案:B
本题解析:
试题分析:醋酸是弱酸,存在电离平衡CH3COOH CH3COO-+H+。醋酸钠能抑制醋酸的电离,但pH增大,A不正确;氯化氢能增大氢离子浓度,pH减小,且抑制醋酸的电离,B正确;电离吸热,加热促进电离,pH减小,C不正确;增大醋酸的浓度,pH减小,促进电离,D不正确,答案选B。
CH3COO-+H+。醋酸钠能抑制醋酸的电离,但pH增大,A不正确;氯化氢能增大氢离子浓度,pH减小,且抑制醋酸的电离,B正确;电离吸热,加热促进电离,pH减小,C不正确;增大醋酸的浓度,pH减小,促进电离,D不正确,答案选B。
点评:增大醋酸的浓度
本题难度:一般
5、填空题 (1) 25℃时,部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 | Ki=1.7×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 ①HCOONa溶液呈??????性(填“酸”、“碱”或“中”),其原因是???????????????????????????????? (用离子方程式表示)。 ②在测定c(H+)相等的盐酸和HCOOH溶液的pH时,某同学先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测,用此法误差较大的是________(填“盐酸”或“HCOOH”),原因是??????????????????????????????????????????????????????????????????。 ③将少量CO2通入NaCN溶液中,它们是否能反应(若能,写出反应的离子方程式;若不能,直接填“否”)????????????????。 (2)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:  ①M、N点对应的温度分别是T1、T2,则T1???T2(填“>”、“=”或“<”)。 ②T2时,水的离子积常数Kw=?????????????????,pH=9的NaOH溶液中,由水电离产生的c(H+)=?????????????mol/L。 参考答案:(1)①碱 ?(2分)??????? HCOO-+H2O 本题解析: 本题难度:一般 |