时间:2017-01-24 19:27:28
1、选择题 amolFeS与bmolFe3O4投入到VL?cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为 [???? ]
A. ???
???
B.(a+3b)mol???
C. ???
???
D.(cV-3a-9b)mol
参考答案:A
本题解析:
本题难度:一般
2、选择题 羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原.现用25.00 mL0.049 mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.65 mL 0.020 mol/L的KMnO4酸性溶液完全作用(已知:FeSO4+KMnO4+H2SO4=Fe2(SO4)3+K2SO4+MnSO4+H2O(未配平)),则在上述反应中,羟胺的氧化产物是
A.N2
B.N2O
C.NO
D.NO2
参考答案:B
本题解析:
本题难度:一般
3、选择题 电解100 mL含c(H+)=0.30 mol/L的下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是 [???? ]
A.0.10 mol/L Ag+
B.0.20 mol/L Zn2+
C.0.20 mol/L Cu2+
D.0.20 mol/L Pb2+
参考答案:C
本题解析:
本题难度:一般
4、选择题 amolFeS与bmolFe3O4投入到VL?cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为 [???? ]
A.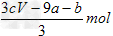 ???
???
B.(a+3b)mol???
C.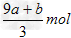 ???
???
D.(cV-3a-9b)mol
参考答案:A
本题解析:
本题难度:一般
5、选择题 下列说法中正确的是
A.处于最高价态的元素不一定具有强氧化性
B.元素由游离态转为化合态,说明该元素一定被氧化
C.阳离子只有氧化性,阴离子只有还原性
D.金属元素只有还原性,非金属元素只有氧化性
参考答案:A
本题解析:
本题难度:一般