时间:2017-01-24 19:04:27
1、选择题 常温下下列四种溶液,由水电离生成的H+的物质的量浓度之比为(???)
①pH=0的盐酸?②0.1 mol·L-1的盐酸?③0.01 mol·L-1的NAOH溶液?④pH=11的NAOH溶液
A.1∶10∶100∶1000
B.0∶1∶12∶11
C.14∶13∶12∶11
D.14∶13∶2∶1
参考答案:A
本题解析:①中,c(H+)="1" mol·L-1,c(OH-)= (H+)=10-14 mol·L-1
(H+)=10-14 mol·L-1
②中,c(H+)="0.1" mol·L-1,c(OH-)= 本题难度:简单
本题难度:简单
2、选择题 下列水溶液一定呈中性的是
A.pH=7的溶液
B.c(H+)=1.0×10-7mol·L-1的溶液
C.c(H+) =c(OH-)
D.pH=3的与pH=11的碱等体积混合后的溶液
参考答案:C
本题解析:溶液的酸碱性是由c(H+)与c(OH-)的相对大小决定的
本题难度:简单
3、选择题 在中和热测定的实验时,应使用的仪器正确组合是( )。
①天平②量筒③烧杯④酒精灯⑤温度计⑥试管⑦量热计⑧环形玻璃搅拌棒
A.①②④⑤⑧ B②③⑤⑦⑧ C. ②③④⑦⑧ D.全部
参考答案:B
本题解析:根据中和热的测定原理可知,在该实验中需要的仪器是选项B。反应不需要称量和加热,所以天平、酒精灯不需要。反应是在烧杯中进行的,不需要试管。答案选B。
本题难度:一般
4、选择题 室温下,用0.100 0 mol·L-1NaOH溶液分别滴定体积均为20.00 mL的盐酸和醋酸溶液,滴定曲线如右图。下列说法正确的是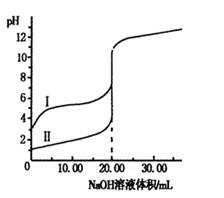
A.I、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.盐酸和醋酸的浓度均为0.100 0 mol·L-1
C.pH=7时,两种酸所消耗NaOH溶液的体积相等
D.V(NaOH)=20.00mL时,c(Cl一)=c(CH3COO一)
参考答案:B
本题解析:
试题分析:A、根据图像可知,曲线发生突变时均消耗20.00ml氢氧化钠溶液,这说明醋酸和盐酸的起始浓度均是0.100 0 mol/L。滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图Ⅱ,滴定醋酸的曲线是图Ⅰ,故A错误;B、根据A中分析可知,盐酸和醋酸的浓度均为0.100 0 mol/L,故B正确;C、醋酸钠水解呈碱性,氯化钠不水解,pH=7时,醋酸所用NaOH溶液的体积小,故C错误;D、V(NaOH)=20.00?mL?时,二者反应生成氯化钠
本题难度:一般
5、填空题 (9分)(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是____________________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:__________________;负极的电极反应式:_______________。
(3)下图是一个电解过程示意图。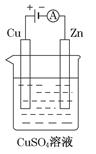
①锌片上发生的电极反应式是:_____________________________。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
参考答案:(1)N2H4(l)+O2(g)=N2(g)+2H2O(l)
本题解析:
试题分析:(1)1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),则1molN2H4即32g在氧气中完全燃烧生成氮气和H2O,放出19.5kJ×32=624 kJ热量,因此表示N2H4燃烧热的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(l) ΔH=-624 kJ·mol-1。
(2)原电池中负极失去电子,发生氧化反应,正极得到电子发生还原反应,因此该原电池中正极反应式为O2+2H2O+4e-=4OH-,负极是肼失去电子,电极反应式为N2H4+4OH--4e-=4H2O+N2↑。
(3)①锌与电源的负极相连,作阴极,溶液中的铜离子放电,电极反应式为Cu2++2e-=Cu。
②铜片质量变化为128g,即电解128g铜时失去电子的物质的量是 ×2=4mol,因此根据电子得失守恒可知消耗氧气的物质的量是1mol,在标准状况下的体积是22.4L,所以需要空气的体积是22.4L×5=112L。
×2=4mol,因此根据电子得失守恒可知消耗氧气的物质的量是1mol,在标准状况下的体积是22.4L,所以需要空气的体积是22.4L×5=112L。
考点:考查热化学方程式书写以及电化学原理的应用
本题难度:一般