时间:2017-01-24 19:02:28
1、选择题 下列各组元素属于p区的是?[???? ]
A.原子序数为1、2、7的元素 ??
B.O、S、P ??
C.Fe、Ar、Cl ??
D.Na、Li、Mg
2、选择题 下列各组物质的性质比较,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4
B.氢化物稳定性:HF>H2O>H2S
C.还原性:Al>Mg>K>Na
D.半径:Na>S>Cl
3、填空题 在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表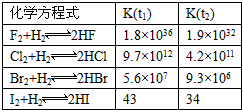
⑴已知t2>t1,HX的生成反应是________反应(填“吸热”或“放热”)。
⑵HX的电子式是________。
⑶共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是________。
⑷X2都能与H2反应生成HX,用原子结构解释原因:________________。
⑸K的变化体现出X2化学性质的递变性,用原子结构解释原因:________________,原子半径逐渐增大,得电子能力逐渐减弱。
⑹仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,________(选填字母)。
a. 在相同条件下,平衡时X2的转化率逐渐降低
b. X2与H2反应的剧烈程度逐渐减弱
c. HX的还原性逐渐减弱
d. HX的稳定性逐渐减弱
4、选择题 元素X的原子获得3个电子与元素Y的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同。X、Y两种元素的单质在高温下反应得到的化合物的正确化学式为 [???? ]
A.X2Y3
B.Y3X2
C.Y2X3
D.X3Y2
5、填空题 稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。
我国蕴藏着丰富的钇矿石( Y2 FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下: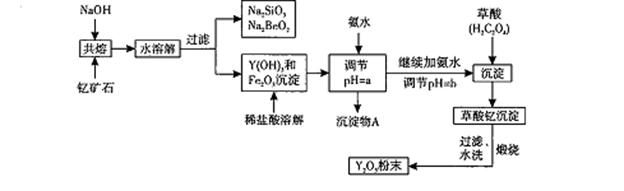
已知:
I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| ? | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 ? Ⅱ.在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。 (1)钇矿石(Y2 FeBe2Si2O10)的组成用氧化物的形式可表示为??????????。 (2)欲从Na2 SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则 ①最好选用盐酸、?????(填字母代号)两种试剂,再通过必要的实验操作方可实现。 a.NaOH溶液??? b.氨水??? c.CO2气??? d.HNO3 ②写出Na2BeO2与足量盐酸发生反应的离子方程式:???????????????:必要的实验操作应是????????????????。 (3)为使Fe3+沉淀完全,须用氨水调节pH =a,则a应控制在??????的范围内;继续加氨 水调节pH =b发生反应的离子方程式为????????????????,溶液中Fe3+完全沉淀的判定标准是??????????????????。 (4)写出草酸钇[Y2(C2O4)3.Nh2O]煅烧的化学方程式??????????????。 |