时间:2017-01-24 18:58:31
1、选择题 常温下Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液的清液混合,再向其中加入一定量的AgNO3固体,下列说法正确的是( )
A.两清液混合,AgCl和AgI都沉淀
B.向AgI清液加入AgNO3,c(Ag+)增大,KSp(AgI)也增大
C.若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主
D.若取0.1435克AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01mol/L
2、选择题 将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,发生的反应为( )
A.只有AgBr沉淀生成
B.AgCl与AgBr沉淀等量生成
C.AgCl与AgBr沉淀都有,但以AgCl沉淀为主
D.AgCl与AgBr沉淀都有,但以AgBr沉淀为主
3、填空题 ?某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳??????离子浓度随溶液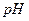 的变化如图所示。下列判断正确的是
的变化如图所示。下列判断正确的是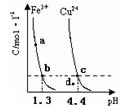
A.加适量浓NH3·H2O可使溶液由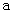 点变到
点变到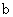 点
点
B.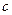
 两点代表的溶液中
两点代表的溶液中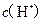 与
与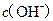 乘积不相等
乘积不相等
C.Cu(OH)2在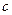 点比在d点代表的溶液中溶解程度小
点比在d点代表的溶液中溶解程度小
D.该温度下,氢氧化铁的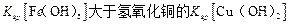
4、计算题 与水的离子积Kw=[H+]·[OH-]相似,FeS饱和溶液中也有离了积KSP=[Fe2+]·[S2-]。已知t℃时FeS的KSP=6.25×10-18,则t℃时饱和FeS溶液的物质的量浓度为____。又知t℃时H2S饱和溶液中[H+]2[S2-]=1.0×10-22,现将适量FeS投入H2S饱和溶液中要使[Fe2+]达到1mol·L-1,则应将溶液的pH调节到____。如已知CuS的离子积KSP=9.1×10-36,现将适量CuS放入H2S饱和溶液中,要使[Cu2+]达到0.01 mol·L-1时,应使该溶液的[H+]达到____。由此说明CuS在一般酸中能否溶解?
5、简答题 向BaCl2溶液中先后滴加AgNO3和KBr,当两种沉淀共存时,
| c(Br-) c(Cl-) =______.[KSP(AgBr)=5.4×10-13,KSP(AgCl)=2.0×10-10]. |