时间:2017-01-24 18:48:59
1、实验题 (1)(4分)胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8.nH2O)等化合物。三硅酸镁的氧化物形式为???????,某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径???????(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:??????????????????????????????
(2)(2分) Al2O3、MgO和SiO2都可以制耐火材料,其原因是???????。
a.Al2O3、MgO和SiO2都不溶于水?? b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物 ??d.Al2O3、MgO和SiO2都有很高的熔点
(3)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
①(4分)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,要填写):
②(2分))向盛有KI溶液滴加氯水的整个过程中的还原剂是??????????。
③(2分)把KI换成KBr,则CCl4层变为红棕色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是?????????????????????。
④(2分)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若将KI与Cl2反应制KIO3,至少需要消耗Cl2???????L(标准状况,保留2位小数)。
参考答案:(1)2MgO.3SiO2.nH2O(1分);大(1分);A
本题解析:略
本题难度:一般
2、填空题 已知有以下物质相互转化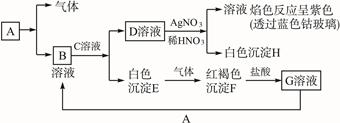
试回答:(1)写出B的化学式________________,D的化学式_______________。
(2)写出由E转变成F的化学方程式________________________________________。?
(3)写出用KSCN鉴别G溶液的离子方程式________;向G溶液加入A的有关离子反应方程式________________________。?
参考答案:(1)FeCl2 KCl
(2)4Fe(OH)2+O
本题解析:因F为红褐色固体,所以F为氢氧化铁,E为氢氧化亚铁,G为氯化铁;又因D与硝酸酸化的硝酸银反应产生白色沉淀,所以D中含有氯离子,而所得溶液的焰色反应呈紫色,说明所得溶液中含有钾离子,综合上述可知B为FeCl2,A为铁。?
本题难度:一般
3、选择题 下列变化不能通过一步实验直接完成的是( )
A.Fe→Fe3O4
B.Fe(OH)3→Fe2O3
C.Al→Al(OH)3
D.Na2O2→Na2CO3
参考答案:A、铁可以与氧气发生反应生成溶液反应生成Fe3O4,能一步实
本题解析:
本题难度:简单
4、选择题 将Al分别加入到溶液质量相同且足量的稀盐酸和烧碱溶液中 ,当产生等质量的气体时,下列说法不正确的是
,当产生等质量的气体时,下列说法不正确的是
A.反应中消耗铝的质量相同 ??????????B.反应中转移的电子数相同
C.反应中消耗的HCl与NaOH物质的量相同??????D.溶液增加的质量相同
参考答案:C
本题解析:略
本题难度:一般
5、选择题 两份等体积等浓度的NaOH溶液,分别与体积相等的AlCl3、MgCl2溶液混合,充分反应后Al3+、Mg2+均恰好完全沉淀,则原AlCl3、MgCl2溶液浓度之比是(? )
A.2∶3
B.1∶2
C.1∶1
D.3∶2
参考答案:A
本题解析:
试题分析:题中NaOH的物质的量相等,充分反应后Al3+、Mg2+均恰好完全沉淀,所以Al(OH)3与Mg(OH)2的物质的量之比为2:3,原AlCl3、MgCl2溶液浓度之比为2:3.
本题难度:简单