时间:2017-01-24 18:46:42
1、选择题 如图是氢氧燃料电池构造示意图,则关于该电池的说法不正确的( )
A.a极是负极
B.正极的电极反应是:O2+2H2O+4e-=4OH-
C.电子由b通过灯泡流向a
D.氢氧燃料电池是环保电池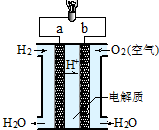
参考答案:A、氢氧燃料电池中,H2在负极a上被氧化,O2在正极b上被还
本题解析:
本题难度:一般
2、选择题 理论上不能设计为原电池的化学反应是(???)
A.CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H<0
B.HNO3(aq)+NaOH(aq)==NaNO3(aq)+H2O(l) △H<0
C.2H2(g)+O2(g)==2H2O(l) △H<0
D.2FeCl3(aq)+Fe(s)==3FeCl3(aq) △H<0
参考答案:B
本题解析:要能够设计成原电池必须是氧化还原反应,硝酸与氢氧化钠的反应不属于氧化还原反应所以答案选B。
本题难度:一般
3、选择题 有关下列图象的说法正确的是 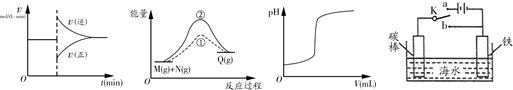
甲 ?????????? 乙 ?????? 丙 ? 丁
A.图甲中的曲线可以表示某化学平衡体系改变温度后反应速率随时间的变化
B.图乙中①、②曲线分别表示反应M(g)+N(g)→Q(g)ΔH >0使用和未使用催化剂时,反应过程中的能量变化
C.图丙中的曲线可表示向一定量的氢氧化钠溶液中滴加一定浓度盐酸时的pH变化
D.图丁中开关K置于a或b处均可减缓铁的腐蚀
参考答案:B
本题解析:
试题分析:A.若某化学平衡体系改变温度,则V正、V逆都要增大或减小。错误。B.由于使用催化剂能降低反应的活化能,使反应在较低的温度下就可以发生,因此反应速率大大加快。但是催化剂不能改变反应物、生成物的能量,所以不能改变化学反应的反应热。正确。C.NaOH溶液是碱性溶液,当向其中滴加HCl时,溶液的pH会逐渐减小,当二者恰好反应时,溶液的pH会发生大的突越。随后溶液逐渐变为酸性溶液,pH逐渐减小。错误。D.图丁中开关K置于a处,该装置为电解池,Fe作阴极,在阴极上发生还原反应,可减缓铁的腐蚀;若开关
本题难度:一般
4、选择题 某同学组装了如图所示的电化学装置电极I为Al,其他电极均为Cu,则
A.电流方向:电极IV→ →电极I
→电极I
B.电极I发生还原反应
C.电极II逐渐溶解
D.电极III的电极反应:Cu2++2e-==Cu
参考答案:A
本题解析:
试题分析:A、由题意可知,该装置的I、II是原电池的两极,I是负极,II是正极,III、IV是电解池的两极,其中III是阳极,IV是阴极,所以电流方向:电极IV→ →电极I,正确;B、电极I是原电池的负极,发生氧化反应,错误;C、电极II是原电池的正极,发生还原反应,有Cu析出,错误;D、电极III是阳极
→电极I,正确;B、电极I是原电池的负极,发生氧化反应,错误;C、电极II是原电池的正极,发生还原反应,有Cu析出,错误;D、电极III是阳极
本题难度:一般
5、填空题 (1)某化学反应,设反应物的总能量为E1,生成物的总能量为E2,若E1>E2,则该反应为______热反应.中和反应都是______热反应,其实质是______.(用离子方程式表示)
(2)如图:A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
①A中反应的离子方程式为______.
②B中Sn极是______极,其电极反应式为______,
③C中被腐蚀的金属是______,总反应的化学方程式为______,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为______(填序号).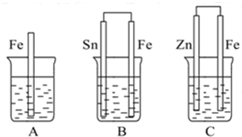
参考答案:(1)设反应物的总能量为E1,生成物的总能量为E2,若E1>
本题解析:
本题难度:一般