时间:2017-01-24 18:46:42
1、选择题 下列有关原电池的说法中,正确的是( )
A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极
B铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀
D.将反应2Fe3++Fe===3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质
2、填空题 (14分)
已知CO(g)+H2O(g) CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 回答下列问题: (1)该反应的△H 0(填“<”“ >”“ =”); (2)830℃时,向一个5 L的密闭容器中充入0.20mol的CO和0.80mol的H2O,反应初始6s内CO的平均反应速率v(CO)="0.003" mol·L-1·s-1,则6S末CO2的物质的量浓度为 ;反应经一段时间后,达到平衡后CO的转化率为 ; (3)判断该反应是否达到平衡的依据为 (填正确选项前的字母); a.压强不随时间改变 b.气体的密度不随时间改变 c.c(CO)不随时间改变 d.单位时间里生成CO和H2的物质的量相等 (4)已知1000℃时,要使CO的转化率超过90%,则起始物c(H2O): c(CO)应不低于 ; (5)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ; (6)已知CO可用于制备很多物质: 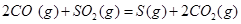 ΔH=+8.0kJ·mol-1 ΔH=+8.0kJ·mol-1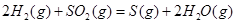 ΔH=+90.4kJ·mol-1 ΔH=+90.4kJ·mol-1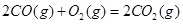 ΔH=-556.0kJ·mol-1 ΔH=-556.0kJ·mol-1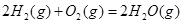 ΔH=-483.6kJ·mol-1 ΔH=-483.6kJ·mol-1请写出 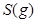 与 与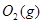 反应生成 反应生成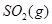 热化学方程式 。 热化学方程式 。 3、选择题 铁-镍蓄电池放电和充电时发生的反应为: 4、填空题 (14分)据图回答下列问题: 5、选择题 原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是 |