时间:2017-01-24 18:37:34
1、选择题 25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g)=2H2O(1)△H=
参考答案:
本题解析:
本题难度:一般
2、选择题 已知下列反应的热化学方程式为:
①C(s)+O2(g)=CO2(g); △H1=—393.5kJ/mol
②CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l);△H2=—870.3kJ/mol
③H2(g)+1/2 O2(g)=H2O(l); △H3=—285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的△H为
A.+488.3kJ/mol
B.—488.3 kJ/mol
C.—244.15 kJ/mol
D.+244.15 kJ/mol
参考答案:B
本题解析:本题主要是根据盖斯定律来求解
将①×2+③×2-②可得:
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=—488.3kJ/mol
故答案为B
本题难度:一般
3、选择题 白磷与氧可发生如下反应:P4+5O2="==" P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的 H,其中正确的是( )
H,其中正确的是( )
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
参考答案:A
本题解析:考查反应热的有关计算。反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据结构简式和方程式可知,该反应的反应热△H=(6a+5d-4c-12b) kJ·mol-1,答案选A。
本题难度:一般
4、填空题 (14分)I.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.5mol液态肼和1mol H2O2混合反应,生成氮气和水蒸气,放出256.5kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44.0kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
II.已知: (s,白磷)+
(s,白磷)+



则白磷转化为红磷为____________反应(填“吸热”或“放热”);白磷的稳定性比红磷___________(填“高”或“低”)。
III.能较准确地反映丙烷燃烧时能量变化的曲线是________。
参考答案:I.(1)N2H4(l)+2H2O2(l) ="=" N2(
本题解析:
试题解析:(1)解:液态肼和H2O2混合反应,反应方程式为:N2H4+2H2O2=N2+4H2O,0.4mol液态肼放出akJ的热量,则1mol液态肼放出的热量为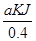 =
= ,所以反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-
,所以反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-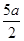 kJ/mol;(2)①N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-
kJ/mol;(2)①N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-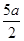 kJ/mol;②H2O(l)=H2O(g)△H=+bkJ/mol,
kJ/mol;②H2O(l)=H2O(g)△H=+bkJ/mol,
依据盖斯定律①-②×4得到N2H4(l)+2H2O2(l)
本题难度:一般
5、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ·mol-1
下列说法正确的是 [???? ]
A.CH3OH的反应热不仅与各物质的状态有关,也与参加反应的反应物的量有关
B.CH3OH蒸气的燃烧热大于676.7kJ·mol-1
C.CH3OH转变成H2的过程只能是一个从高能量到低能量的过程
D.根据①推知反应:CO2(g)+3H2(g)=CH3OH(l)+H2O(g) 的△H<-49.0kJ·mol-1
参考答案:BD
本题解析:
本题难度:一般