时间:2017-01-24 18:31:39
1、选择题 下列关于金属铝的叙述中,说法不正确的是
A.Al 是地壳中含量最多的金属元素
B.Al在化学反应中容易失去3个电子,还原性比镁强
C.铝制餐具不宜长时间存放酸性、碱性或咸的食物
D.铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的铝并不滴落
参考答案:B
本题解析:略
本题难度:简单
2、填空题 甲、乙、丙三种物质之间有如下图所示的转化关系,其中甲物质为氧化物: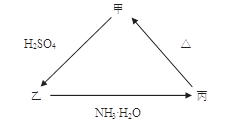
(1)若甲是不溶于水的白色固体,但既能溶于硫酸又能溶于氢氧化钠溶液, 写出下列转化的方程式:
乙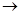 丙的离子方程式______________________; 丙
丙的离子方程式______________________; 丙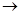 甲的化学方程式____________________。
甲的化学方程式____________________。
(2)若向乙溶液中加入KSCN溶液,混合溶液呈红色,则甲物质是________(填化学式)。 甲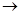 乙的离子方程式是_____________________________。
乙的离子方程式是_____________________________。
参考答案:(1)AI3+ + 3NH3 ? H2O = AI(OH)3
本题解析:
试题分析:(1)氧化物甲是不溶于水的白色固体,既能溶于硫酸又能溶于氢氧化钠溶液的是Al2O3.乙是Al2(SO4)3, 丙是Al(OH)3。乙→丙的离子方程式:AI3+ + 3NH3 ? H2O = AI(OH)3↓ + 3NH4+??丙→甲的化学方程式?2AI(OH)3 AI2O3 + 3H2O.(2)
AI2O3 + 3H2O.(2)
本题难度:一般
3、填空题 锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。回答下列问题:
(1)单质铝溶于过量氢氧化钠溶液后,溶液中铝元素的存在形式为???????(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式:?????????????????????。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是????????????????????????????????????????????????????????????????。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因:???????????????????。
参考答案:(1)[Al(OH)4]- (2)Zn+2NaOH+2H2O
本题解析:(1)Al与NaOH发生反应:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑。溶液中Al以[Al(OH)4]-形式存在。(2)依照Al和NaOH发生的反应,可以写出Zn与NaOH反应的化学方程式:Zn+2NaOH+2H2O=Na2[Zn(OH)4]+H2↑。(3)①少量Al2(SO4)3滴入NaOH中,没有沉淀生成,生成[Al(OH)4]-,少量NaOH滴入Al2(SO4)3中,有沉淀生成。②Al2(SO4)3滴入氨水中,有沉淀生成;氨水滴入Al2(SO4)3中,也有沉淀生成。③少量Zn
本题难度:一般
4、推断题 甲、乙、丙三种物质之间有如图所示的转化关系
(1)若甲是不溶于水的白色固体氧化物,但既能溶于硫酸又能溶于氢氧化钠溶液,写出下列转化的方程式:
乙→丙的离子方程式______________________________________,
丙→甲的化学方程式______________________________________。
(2)若向乙溶液中加入KSCN溶液,混合溶液呈红色,则甲物质是_______________(写化学式)
甲→乙的离子方程式是_________________________________________。
参考答案:(1)Al3++3NH3·H2O=Al(OH)3↓+3NH4
本题解析:
本题难度:一般
5、填空题 胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:①白色结晶状粉末,可缓缓分解。
②能溶于水,水溶液呈弱碱性。
③遇酸及酸性药物则产生二氧化碳。
④胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:①与胃酸作用是中和反应,作用缓慢而持久,可维持3~4小时。
②凝胶本身覆盖于溃疡面上,具有保护作用。
③可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成分是____ (填化学式);乙中含有的主要化学成分是____ (填化学式)。
(2)试写出甲中含有的主要化学成分引起胃胀气反应的离子方程式:____ 。
(3)试写出乙中含有的主要化学成分溶于NaOH溶液的离子方程式:____。
参考答案:(1)NaHCO3 ;Al(OH)3
(2)HCO3-
本题解析:
本题难度:一般