时间:2017-01-24 18:28:23
1、计算题 (9分)向Fe3O4和 Fe的固体混合物6.88g中加入50ml 2 mol·L—1H2SO4,恰好使固体完全溶解,并放出一定量气体。在所得溶液中加入KSCN溶液,溶液不变红色。
(1)??????????????写出Fe3O4和稀H2SO4反应的化学方程式______________________________。
(2)??????????????混合物中Fe3O4和 Fe的物质的量(写出计算过程)。
(3)??????????????求反应中产生的气体在标准状况下的体积。(写出计算过程)。
若用足量的CO在高温下与相同质量的上述固体混合物反应,求最终能得到铁的质量。(写出计算过程)。
参考答案:(1)Fe3O4+4H2SO4==FeSO4+Fe2(SO4
本题解析:(2)设Fe、Fe3O4的物质的量分别为n1,n2,
56n1+232n2="6.88g" ①
据题意,得:反应过程中,发生了以下3个反应,
Fe3O4+4H2SO4==FeSO4+Fe2(SO4)3+4H2O? Fe+Fe2(SO4)3=3FeSO4????Fe+H2SO4=FeSO4+H2↑
1??? 4???????????? 1?????????? 1??? 1???????????????? 1?? 1??
n2?? 4n2?????????? n2???????
本题难度:一般
2、实验题 (12分)实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
(1)如何检查装置A的气密性?
??????????????????????????????????????????????????????????????????????_
(2)装置A发生的反应有时要向其中加入少量CuSO4溶液,其目的是??????????????,
其原理是???????????????????????????????????????????????????????????????。
(3)为了安全,在点燃D处的酒精灯之前,在b出口处必须??????????????????????。
(4)装置B的作用是????????????????????????????????????????????????????????;
装置C中装的液体是??????????????????,所起的作用是????????????????????。
(5)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生反应的化学方程式是?????????????????????????????????????????????。
(6)若FeO和Fe2O3固体混合物的质量为23.2 g,反应完全后U型管的质量增加7.2 g,则混合物中Fe2O3的质量为???????????g。
(7)U形管E右边又连接干燥管F的目的是????????????????????????,若无干燥管F,测得Fe2O3的质量将?????????(填“偏大”、“偏小”或“无影响”)。
(8)若反应后得到的残留固体中还有少量FeO,测得的Fe2O3质量将?????????(填“偏大”、“偏小”或“无影响”)。
参考答案:(12分,每空1分) (1)关闭a,从球形漏斗口加水,待水从
本题解析:(1)A装置是启普发生器,所以检验气密性的方法是关闭a,从球形漏斗口加水,
待水从漏斗管上升与容器中的水面形成一段水柱,停止加水,静置片刻,如水柱不下降,证
明其气密性良好。
(2)由于Zn先与CuSO4反应生成Cu附着在Zn表面,Zn(负极)、Cu(正极)与稀盐酸(电解质溶液)组成很多微小原电池,发生原电池反应,从而加快了反应速率。
(3)氢气是可燃性气体,点燃之前必需检验氢气的纯度。
(4)由于生成的氢气中含有氯化氢和水蒸气,而这两种杂质都能干扰实验的,实验B中盛有饱和食
本题难度:一般
3、选择题 下列物质不可以通过化合反应制取的是
A.FeCl2
B.Fe(OH) 3
C.H 2SiO4
D.SO3
参考答案:C
本题解析:A:2FeCl3+Fe=3FeCl2
B:4Fe(OH)2+O2+4H2O=4Fe(OH)3
C:无符合题意方程式
D:2SO2+O2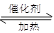 2SO3
2SO3
答案为C
本题难度:一般
4、填空题 为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理经处理后钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。主要反应如①②③:
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+NH3+H2O
② ___Na2FeO2+____NaNO2+____H2O = ????N a2Fe2O4+????NH3+????NaOH
a2Fe2O4+????NH3+????NaOH
③ Na2FeO2+Na2Fe2O4+2H2O  ?Fe3O4+4NaOH
?Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应②中还原剂为??????????????,被还原物质是????????? 。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
(3)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是:???????????????。
参考答案:本题解析:略
本题难度:一般
5、填空题 把等物质的量的Cu、Fe粉投入一定量的FeCl3溶液中充分反应后取出部分溶液,
(1)若滴加一滴KSCN溶液,溶液显红色,则溶液中存在的离子有_________。
(2)若加一滴KSCN溶液,溶液不显红色,则溶液中一定存在的离子有_________,可能存在的金属粉末有_________。
(3)若加入的金属全部溶解,则溶液中n(Cu2+):n(Fe2+)是_________。
(4)若(3)反应后的溶液中有3种金属离子,欲从中回收Cu和FeCl3,需要用到的试剂有(按反应顺序填写)___________________________________。
参考答案:(9分)(1)Cu2+、Fe2+、Fe3+、Cl-?????
本题解析:
试题分析:(1)若滴加一滴KSCN溶液,溶液显红色,说明一定含有铁离子,则铜和铁完全被氧化,因此溶液中存在的离子有Cu2+、Fe2+、Fe3+、Cl-。
(2)若加一滴KSCN溶液,溶液不显红色,说明溶液中不存在铁离子。由于铁的金属性强于铜的,所以铁首先被氧化,则溶液中一定存在的离子有Fe2+、Cl- ,可能存在的金属粉末有铁和铜。
(3)若加入的金属全部溶解,则根据反应式2Fe3++Fe=3Fe2+、2Fe3++Cu=2Fe2++Cu2+可知溶液中n(Cu2+):n(Fe2+)是1:
本题难度:一般