时间:2017-01-24 18:28:23
1、简答题 (1)现有含Fe2O380%的赤铁矿100t,理论上可冶炼含Fe95%的生铁多少吨?
(2)准确称取6g铝土矿(含Fe2O3、Al2O3)样品,放入盛有100mLHCl的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀的量与所加NaOH溶液的体积的关系如图所示.试求:
①盐酸的物质的量浓度是多少?
②若b=2.3,则铝土矿中氧化铝的质量分数是多少?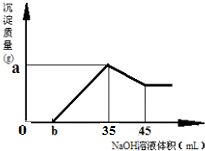
参考答案:(1)由题目可知,m( Fe2O3)═100t×80%═80
本题解析:
本题难度:一般
2、填空题 (14分)针对苏教版化学I第75页上“铁与氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为+2价铁的化合物,如果与氧化性较强的氧化剂(如氯气、双氧水等)反应则转化为+3价的化合物”的叙述,化学研究性学习小组拟通过以下实验探究“新制的还原性铁粉和盐酸的反应(铁过量)”。请你参与探究并回答有关问题:
(1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是??????????????????????????;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是:???????????????????????;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速 产生大量气泡,写出产生该现象的化学方程式:???????????????????????????????????????。
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式???????????????????????????。
(3)探究高铁酸钾的某种性质。
[实验1]将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。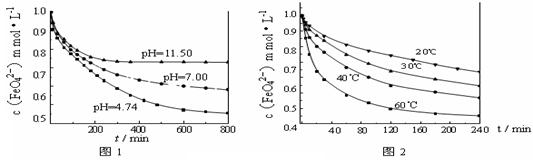
[实验2]将适量K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为1.0 mmol·L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是????????????????????????????????????????????????????????;
②实验2可得出的结论是??????????????????????????????????????????????????;
③高铁酸钾在水中的反应为4 FeO42-+10 H2O 4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是??????????????????????????????????????????????????????????????。
4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是??????????????????????????????????????????????????????????????。
参考答案:(14分)(1)先加硫氰化钾溶液,无现象,再滴加双氧水少许,
本题解析:(1)亚铁离子具有还原性,据此可以鉴别,微粒排除铁离子的干扰,有关首先加热KSCN溶液,即先加硫氰化钾溶液,无现象,再滴加双氧水少许,看到溶液呈血红色;由于硫氰根也极易被氧化,所以在实验中往往又看到血红色迅速褪去;双氧水不稳定,易分解生成氧气,反应的方程式是2H2O2 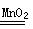 2H2O+O2↑。
2H2O+O2↑。
(2)根据反应物
本题难度:一般
3、选择题 在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述正确的是
A.白色沉淀是BaSO4和BaSO3
B.溶液的酸性减弱
C.白色沉淀是BaSO3
D.FeCl3全部被还原为FeCl2
参考答案:D
本题解析:由于氯化铁具有氧化性,能氧化SO2,生成硫酸和氯化亚铁,所以白色沉淀是硫酸钡,所以选项D正确,答案选D。
本题难度:一般
4、选择题
A.9.6 g
B.6.4 g
C.3.2 g
D.1.6 g
参考答案:C
本题解析:由题意知,Cu、Ag与HNO3反应所得还原产物与O2作用溶于水后又变为HNO3,因此可以认为Cu、Ag所失电子最终被O2而非HNO3所得。
设Cu、Ag物质的量分别为x、y,则: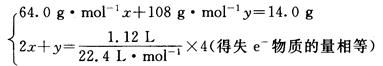
解得:x="0.050" mol,m(Cu)="64"
本题难度:一般
5、简答题 三氯化铁是中学化学实验室中常用的化学试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3?6H2O,该同学设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3?6H2O晶体.填写下列空白:
(1)收集导管B处的气体可采用的方法是______.滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是______.
(2)烧杯内放过量稀HNO3的原因是______.发生反应的离子方程式是______.
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是______.
(4)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3?6H2O,而不用直接蒸干的方法来制得晶体的理由是______
(5)你认为该实验存在的缺点可能有:______.
参考答案:(1)导管B处的气体为氢气,氢气密度比空气小且不溶于水,可用
本题解析:
本题难度:一般