时间:2017-01-24 18:24:29
1、实验题 (1)实验室用二氧化锰跟浓盐酸反应制取氯气的离子方程式为???????????????。
(2)高锰酸钾是常用氧化剂,在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气的离子方程式为?????????????????????????????????。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,反应的化学方程式为??????????????????????????????????。
(4)现有100 mL AlCl3与MgSO4的混合溶液,分成两等份。
① 向其中一份中加入10 mL 4 mol/L的氨水,恰好完全沉淀,其中AlCl3与氨水反应的离子方程式是??????????。继续加入1 mol/L NaOH溶液至10 mL时,沉淀不再减少,沉淀减少的离子方程式是??????????,减少的沉淀的物质的量是??????????。
② 向另一份中加入a mL 1 mol/LBaCl2溶液能使SO42-沉淀完全,a=??????????。
参考答案:(14分)(1)MnO2+4H++2Cl-
本题解析:
试题分析:(1)、实验室常用二氧化锰氧化浓盐酸法制取氯气,在加热时反应生成二氯化锰、氯气和水,化合价升降总数均为2;(2)、高锰酸钾的氧化性比二氧化锰强,常温下能氧化浓盐酸,生成氯化钾、二氯化锰、氯气和水,化合价升降总数均为10;(3)、根据氧化还原反应方程式的配平方法可知,氯化氢气体被氧气催化氧化为氯气和水蒸气,化合价升降总数均为4;(4)、①完全沉淀之前反应式为A13+ + 3NH3?H2O=Al(OH)3↓+ 3NH4+、Mg2++2NH3?H2O=Mg(OH)2↓+ 2NH4+;完全沉淀之
本题难度:一般
2、计算题 (10分)将一定质量的镁、铝合金,投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加5 mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示,由图中数据分析计算: 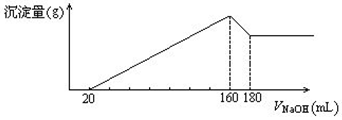
⑴ 求原合金中镁、铝的质量?
⑵ 求盐酸的物质的量浓度?
参考答案:(10分) 4.8g(3分) 2.7g(3分)??? 8mo
本题解析:略
本题难度:一般
3、选择题 下列物质的溶液加热蒸发至干,灼烧,所得固体的成分不相同的是[???? ]
A.FeCl2、FeCl3
B.NaHCO3、Na2CO3
C.NaAlO2、AlCl3
D.Mg(HCO3)2、MgCl2
参考答案:C
本题解析:
本题难度:一般
4、填空题 由铝土矿(主要成分是Al2O3)炼制铝的工艺流程示意图如下: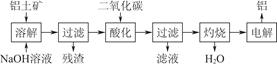
(1)电解生成的铝在熔融液的???????(填“上层”或“下层”),电解时不断消耗的电极是???????(填“阴极”或“阳极”)。
(2)写出通入过量二氧化碳酸化时反应的离子方程式???????????????????????????????????????????????????????????????????????
???????????????????????????????????????????????????????????????????????。
(3)电解制备铝时,需加入冰晶石(Na3AlF6),其作用是???????????,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,写出该反应的化学方程式???????????????????????????????????????????????????????????????????????。
(4)上述工艺所得铝中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池的阴极材料是???????(填化学式),阳极的电极反应式为???????????????????????????????????????????????????????????????????????。
(5)对金属制品进行抗腐蚀处理,可延长其使用寿命。
①控制一定条件进行电解(见图),此时铝表面可形成耐酸的致密氧化膜,其电极反应式为?????????????????????????????????;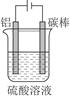
②钢材镀铝后,能防止钢材腐蚀,其原因是???????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????。
参考答案:(1)下层 阳极
(2)AlO2-+CO2+2H2O=
本题解析:(1)电解熔融的氧化铝冶炼铝,阳极生成O2,与石墨电极反应生成CO。(3)氧化铝的熔点很高,是常用的耐高温材料,故冶炼时加入冰晶石降低其熔点。(4)迁移电解法精炼铜的原理,电解时铝在阴极析出,故阴极材料为纯铝。(5)根据题中信息,铝表面生成的应为Al2O3,故阳极电极反应为铝失去电子,生成的Al3+与H2O作用形成Al2O3。
本题难度:一般
5、填空题 铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提炼Al2O3并制取铝的流程如下: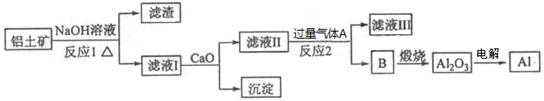
请回答下列问题:
(1)铝与NaOH溶液反应的离子方程式为??????????????????????????????????。
(2)图中涉及分离溶液与沉淀的玻璃仪器有烧杯、玻璃棒、_________。
(3)反应1涉及的化学方程式有?????????????????????、??????????????????????????。滤液Ⅰ中加入CaO生成的沉淀是_?????(填化学式)。
(4)向滤液Ⅱ中通入气体A为??????????????,生成沉淀B的离子方程式为??????????????????????。
参考答案:(1)2Al+2H2O+2OH-=2AlO2-+3H2↑??
本题解析:
试题分析:(1)铝与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑;(2)图中涉及分离溶液与沉淀的玻璃仪器有烧杯、玻璃棒、漏斗;(3)二氧化硅与氢氧化钠反应生成硅酸钠与水,反应方程式为:2NaOH+SiO2═Na2SiO3+H2O,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:2NaOH+Al2O3═2NaAlO2+H2O;滤液Ⅰ中含有硅酸钠、偏铝酸钠,加入CaO,生成氢氧化钙;(4)由工艺流程可知,B为氢氧化铝,故气体A为二氧化碳,滤液Ⅱ主要是偏铝酸钠,偏
本题难度:一般