时间:2017-01-24 18:18:54
1、实验题 某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。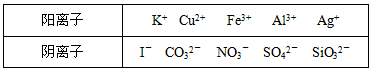
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,呈紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清。
Ⅲ.另取溶液加入BaCl2溶液,有白色沉淀生成,加稀硝酸沉淀无变化。请推断:
(1)由Ⅰ判断,溶液中一定含有的阳离子是_________(写离子符号)。
(2)Fe3+是否存在?______,判断的理由是__________________。
(3)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是_________________________。将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为_________________________
(4)甲同学最终确定原溶液中所含阳离子是________,阴离子是________。(写离子符号)
(5)另取100mL原溶液,加入足量的氨水,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为
_________g。
参考答案:(1)K+
(2)否;Fe3+与I-可发生氧化还原反
本题解析:
本题难度:一般
2、简答题 高锰酸钾是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.如图是实验室制备的操作流程:
上述反应②的化学方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3
已知:
| 物质 | K2CO3 | KHCO3 | K2SO4 | CH3COOK 293K溶解度(g) 111 33.7 11.1 217 (1)加热软锰矿、KClO3和KOH固体时,不采用瓷坩埚而选用铁坩埚的理由是______;反应①的化学方程式为______. (2)从滤液中得到KMnO4晶体的实验操作依次是______(选填字母代号,下同). a.蒸馏b.蒸发c.灼烧d.抽滤e.冷却结晶 (3)制备过程中需要用到纯净的CO2气体.制取纯CO2净最好选择下列试剂中______. a.石灰石b.浓盐酸c.稀疏酸d.纯碱 (4)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.原因是______. (5)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中______,得到的产品纯度更高. a.醋酸b.浓盐酸c.稀硫酸. 参考答案:(1)瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀,加热软锰矿、 本题解析: 本题难度:一般 3、实验题 某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如下图所示的装置。 参考答案:(1)Cu + 2H2SO4(浓) 本题难度:一般 4、实验题 (13分)实验室用燃料法测定某种氨基酸(CxHyOzNp)的分子式组成,取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置置进行实验(铁架台、铁夹、酒精灯等未画出)。请回答有关问题: 参考答案: 本题难度:一般 5、实验题 已知明矾[KAl(SO4)2·12H2O]在水中可解离出K+、Al3+和SO42-,某学习小组为探究明矾中何种离子起净水作用,做如下实验,请你完成实验报告。 参考答案:烧杯中的水变澄清;K+不能起净水作用;③AlCl3或Al(N 本题解析: 本题难度:一般 |