时间:2017-01-24 18:18:15
1、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是: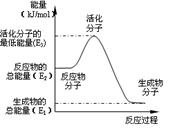
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)? △H1=+ 49.0 kJ·mol -1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)? △H2=-192.9 kJ·mol -1
下列说法正确的是
A.根据②推知:在25℃,101 kPa时,1mol CH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9 kJ
B.反应②中的能量变化如右图所示,则△H2= E1- E3
C.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收能量
D.CH3OH的燃烧热△H=-192.9 kJ·mol -1
2、选择题 下列措施对增大反应速率明显有效的是
A.将煤块磨成煤粉在“沸腾炉”中燃烧
B.Na与水反应时增大水的用量
C.FeCl3和NaOH两溶液反应时,增大压强
D.Fe与稀硫酸反应制取H2时,改为98%的浓硫酸
3、选择题 下列对有关化学反应过程或实验现象的解释中,正确的是
A.NH3的水溶液可以导电,说明NH3是电解质[来源:]
B.在高温条件下,C能置换出SiO2中的Si
C.说明C的氧化性强于Si。[来源:学§科§网]
D.在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液,溶液褪色,说明CaCl2溶液有酸性
E.向淀粉碘化钾的溶液中加入溴水,溶液变为蓝色,说明Br2的氧化性强于I2
4、选择题 下列物质的变化过程中,有共价键明显被破坏的是
A.I2升华
B.NaCl颗粒被粉碎
C.HCl溶于水得盐酸
D.从NH4HCO3中闻到了刺激性气味
5、选择题 下列说法中正确的是
A.难失电子的原子,获得电子的能力一定强
B.易得电子的原子所形成的简单阴离子,其还原性一定强
C.在离子化合物中不可能存在非极性键
D.离子化合物在熔融状态下都能导电
1、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)? △H1=+ 49.0 kJ·mol -1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)? △H2=-192.9 kJ·mol -1
下列说法正确的是
A.根据②推知:在25℃,101 kPa时,1mol CH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9 kJ
B.反应②中的能量变化如右图所示,则△H2= E1- E3
C.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收能量
D.CH3OH的燃烧热△H=-192.9 kJ·mol -1
参考答案:A
本题解析:根据②推知:在25℃,101 kPa时,1mol CH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9 kJ ,因为还要包括氢气继续燃烧放出的热量,故A正确,D错误。反应②中的能量变化△H2= E1- E2,B错误;由反应②推知CH3OH转变成H2的过程可以释放能量,C错误;
本题难度:一般
2、选择题 下列措施对增大反应速率明显有效的是
A.将煤块磨成煤粉在“沸腾炉”中燃烧
B.Na与水反应时增大水的用量
C.FeCl3和NaOH两溶液反应时,增大压强
D.Fe与稀硫酸反应制取H2时,改为98%的浓硫酸
参考答案:A
本题解析:A项增大反应物接触面积,反应速率加快;B中增加水的用量并不改变反应物浓度与接触面积,对反应速率无影响。C项反应物中没有气体,增大压强对反应物浓度无影响,故反应速率不变; D项Fe与浓硫酸钝化,不能产生H2,所以答案选A。
本题难度:简单
3、选择题 下列对有关化学反应过程或实验现象的解释中,正确的是
A.NH3的水溶液可以导电,说明NH3是电解质[来源:]
B.在高温条件下,C能置换出SiO2中的Si
C.说明C的氧化性强于Si。[来源:学§科§网]
D.在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液,溶液褪色,说明CaCl2溶液有酸性
E.向淀粉碘化钾的溶液中加入溴水,溶液变为蓝色,说明Br2的氧化性强于I2
参考答案:D
本题解析:NH3的水溶液可以导电是因为NH3与水反应生成的NH3?H2O电离生成的离子而导电,并非NH3本身电离,A错;C能置换出SiO2中的Si,说明C的还原性强于Si。B错;Na2CO3水解使;滴有酚酞的溶液显红色,加入CaCl2后将CO32-离子沉淀而褪色,并非CaCl2溶液有酸性,C错;向淀粉碘化钾的溶液中加入溴水,溶液变为蓝色,说明有碘生成,表明Br2的氧化性强于I2,D正确。
本题难度:一般
4、选择题 下列物质的变化过程中,有共价键明显被破坏的是
A.I2升华
B.NaCl颗粒被粉碎
C.HCl溶于水得盐酸
D.从NH4HCO3中闻到了刺激性气味
参考答案:C
本题解析:I2升华只破坏分子间作用力;NaCl颗粒粉碎未破坏化学键;HCl溶于水电离成H+和Cl-,只破坏共价键;NH4HCO3分解产生NH3、H2O和CO2,既破坏离子键,又破坏共价键。
本题难度:简单
5、选择题 下列说法中正确的是
A.难失电子的原子,获得电子的能力一定强
B.易得电子的原子所形成的简单阴离子,其还原性一定强
C.在离子化合物中不可能存在非极性键
D.离子化合物在熔融状态下都能导电
参考答案:D
本题解析:稀有气体元素原子既难失电子也难得电子,故A项不正确;F原子得电子的能力较强,但F-却很难失去电子,其还原性较差,B项不正确;Na2O2是离子化合物,其中的O-O为非极性键.Na2O2是离子化合物,但是含有非极性键,C项错误.
本题难度:一般