时间:2017-01-24 18:17:16
1、选择题 用铂作电极电解500 mL含KNO3和Cu(NO3)2的混合溶液一段时间后,在两极均生成11.2L标准状况下的气体,原溶液中Cu2+的物质的量浓度为(???)
A.0.5 mol/L
B.2 mol/L
C.l mol/L
D.无法确定
参考答案:C
本题解析:
正确答案:C
该过程了生两个反应,先电解Cu (NO3)2溶液,后电解水
2H2O 2H2↑?+? O2↑
2H2↑?+? O2↑
0.5mol??? 0.25mol
2Cu(NO3)2+2H2O本题难度:简单
2、选择题 常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是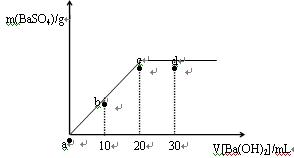
A.硫酸溶液的体积为20 mL
B.b时刻溶液中SO42-的浓度约为0.125 mol·L-1
C.d时刻溶液的pH约为13
D.溶液的导电能力:c<d<b<a
参考答案:B
本题解析:略
本题难度:简单
3、选择题 常温下,取物质的量浓度相等的NaOH和HCl溶液,以3:2体积比相混合,所得溶液pH=12,设混合溶液体积变化忽略不计,则原溶液的浓度为
A.0.01mol/L
B.0.05mol/L
C.0.017mol/L
D.0.50mol/L
参考答案:B
本题解析:
试题分析:溶液的pH=12,所以溶液中OH-的浓度是0.01mol/L,则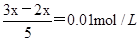 ,解得x=0.05mol/L,答案选B。
,解得x=0.05mol/L,答案选B。
点评:该题是高考中的常见考点和题型,属于基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力。该题的关键是明确pH的计算依据
本题难度:一般
4、选择题 下列叙述正确的是
A.通过沉淀反应,可以使溶液中某种离子的浓度变为0
B.反应NH3+H3O+NH4++H2O能自发进行,说明NH3结合H+能力比H2O强
C.若测得雨水的pH小于7,则下的是酸雨
D.先将pH试纸用蒸馏水润湿后,再测定溶液的pH
参考答案:B
本题解析:
试题分析:通过沉淀反应,不可能使溶液中某种离子的浓度变为0,A不正确;pH小于7的雨水不一定是酸雨,酸雨的pH一般小于5.6,C不正确;测定溶液pH的pH试纸不能事先用水润湿,D不正确,答案选B。
点评:该题是基础性试题的考查,试题考查的知识点比较分散,但很基础。试题侧重能力的培养和解题方法的指导,有助于培养学生的逻辑思维能力和发散思维能力,提高学生分析问题、解决问题的能力。
本题难度:一般
5、实验题 用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: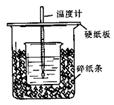
(1)从实验装置上看,图中尚缺少的一种玻璃仪器的名称是???????????????????????。
(2)烧杯间填满碎纸条的作用是??????????????????????????。
(3)大烧杯上如不盖硬纸板,求得的中和热数值??????????(填“偏大、偏小、无影响”)
(4)如果用60mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量????????(填“相等、不相等”),所求中和热?????????(填“相等、不相等”)。
参考答案:(1)环形玻璃搅拌棒(2)减少热量散失(3)偏小(4)不相等
本题解析:考查中和热的测定,主要是注意热量的损耗,尽量减小误差。
(4)参加反应的物质的量不同,放出的热量必然不同,但经折算为中和热后应相等。
本题难度:一般