时间:2017-01-24 18:10:05
1、选择题 强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是
A.△H1>△H2>△H3
B.△H1<△H2<△H3
C.△H1>△H2=△H3
D.△H1=△H2<△H3
参考答案:B
本题解析:中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量。由于浓硫酸溶于水会放出大量的热,而醋酸是弱电解质,存在电离平衡,电离是吸热的,但由于放热越多,△H越小,所以选项B正确,答案选B。
本题难度:一般
2、选择题 下列化学式表示的粒子对H2O的电离平衡不产生影响的是
A.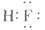
B.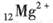
C.
D.
参考答案:C
本题解析:水是一种弱电解质,存在电离平衡,方程式为H2O H++OH-。所以酸或碱能抑制水的电离,而发生水解的某些盐促进水的电离,A、D抑制水的电离,镁离子水解促进水的电离,氯离子既不能促进也不能抑制水的电离,答案选C。
H++OH-。所以酸或碱能抑制水的电离,而发生水解的某些盐促进水的电离,A、D抑制水的电离,镁离子水解促进水的电离,氯离子既不能促进也不能抑制水的电离,答案选C。
本题难度:一般
3、选择题 用已知浓度盐酸滴定未知浓度的NaOH溶液时,下列操作使测定结果(NaOH溶液的浓度)偏高的是
A.滴定达终点时,俯视读数
B.碱液移入锥形瓶后,加入10mL蒸馏水
C.酸式滴定管用蒸馏水洗涤后,未用标准液润洗
D.滴定振荡锥形瓶过程中,有少量溶液溅出
参考答案:C
本题解析:
试题分析:根据C测=C标V标/V测可知,如果滴定达终点时,俯视读数,则读数偏小,消耗盐酸的体积减少,测定结果偏低;碱液移入锥形瓶后,加入10mL蒸馏水,并没有改变碱的物质的量,测定结果不变;酸式滴定管用蒸馏水洗涤后,未用标准液润洗,则盐酸的浓度降低,消耗盐酸的体积增加,测定结果偏高;滴定振荡锥形瓶过程中,有少量溶液溅出,碱液减少,消耗盐酸的体积减少,测定结果偏低,答案选C。
点评:该题是高考中的常见考点之一,试题难易适中,注重基础,侧重能力的考查。该题的关键是明确误差分析的总依据为:由C测=
本题难度:一般
4、选择题 已知: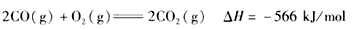
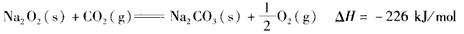
根据以上热化学方程式判断,下列说法正确的是 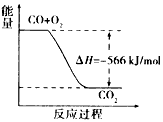 [???? ]
[???? ]
A.CO的燃烧热为283 kJ
B.上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2( s)=== 2Na2CO3(s)+O2(g) △H> -452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6. 02×l023
参考答案:C
本题解析:
本题难度:一般
5、选择题 下图是向100 mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图。根据图所得结论正确的是??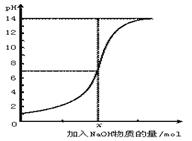
A.原来盐酸的物质的量浓度为1 mol·L-1?
B.原来盐酸的物质的量浓度为0.1 mol·L-1??
C.x处为含NaOH0.1 mol的溶液
D.x处为含NaOH0.001 mol的溶液
参考答案:B
本题解析:在没有加入氢氧化钠之前,盐酸的pH=1,所以其浓度是0.1mol/L的,A不正确,B正确。二者恰好反应时,溶液显中性,需要氢氧化钠是0.01mol,所以选项CD都是错误的,答案选B。
本题难度:一般