时间:2017-01-19 11:55:55
1、填空题 (9分)依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如下图所示。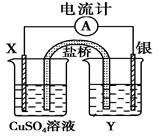
请回答下列问题:
(1)电极X的材料是______;电解质溶液Y是____________;
(2)银电极为电池的________极,发生的电极反应为__________________;X电极上发生的电极反应为____________________________________________________;
(3)外电路中的电子是从________电极流向________电极。
2、选择题 镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳。其中一种镁电池的反应为xMg+Mo3S4 MgxMo3S4,下列说法错误的是( )
MgxMo3S4,下列说法错误的是( )
A.放电时Mg2+向正极迁移
B.放电时正极反应为Mo3S4+2xe-=Mo3S42x-
C.充电时Mo3S4发生氧化反应
D.充电时阴极反应为Mg2++2e-=Mg
3、选择题 镍镉(Ni
4、选择题 下列关于原电池的叙述中正确的是( )
A.原电池能将化学能转变为电能
B.原电池负极发生的电极反应是还原反应
C.原电池在工作时其正极不断产生电子并经外电路流向负极
D.原电池的电极只能由两种不同的金属构成
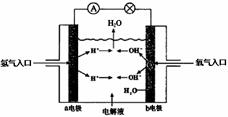
5、填空题 如图为氢氧燃料电池原理示意图,请根据提示写出正负极的电极反应式
(1)以硫酸为电解液:
负极:______
正极:______
(2)以氢氧化钾为电解液:
负极:______
正极:______.