时间:2017-01-19 11:08:01
1、选择题 在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是(?? )
A.AlCl3
B.Na2SO3
C.KMnO4
D.MgSO4
2、选择题 在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示。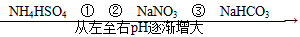
图中①②③可能是( )
A.NH4NO3、(NH4)2SO4、CH3COONa
B.(NH4)2SO4、NH4Cl、C6H5ONa
C.(NH4)2SO4、NH4NO3、Na2CO3
D.(NH4)2SO4、NH4NO3、CH3COONa
3、填空题 以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺流程如下(部分操作和条件略):
I.从废液中提纯并结晶出FeSO4·7H2O;
Ⅱ.将FeSO4·7H2O配制成溶液;
Ⅲ.将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液;
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体;
V.煅烧FeCO3,得到Fe2O3固体;
已知:NH4HCO3在热水中分解。
(1)I中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是____。
(2)Ⅱ中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用______________。
(3)Ⅲ中,生成FeCO3的离子方程式是________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42-的操作是 __________。
(5)已知煅烧FeCO3的化学方程式是:4FeCO3+O2 2Fe2O3+4CO2,现煅烧464.0 kg FeCO3,得到316.8 kg产品,若产品中杂质只有Fe2O3,则该产品中Fe2O3的质量是____kg。
2Fe2O3+4CO2,现煅烧464.0 kg FeCO3,得到316.8 kg产品,若产品中杂质只有Fe2O3,则该产品中Fe2O3的质量是____kg。
4、填空题 常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图像回答下列问题: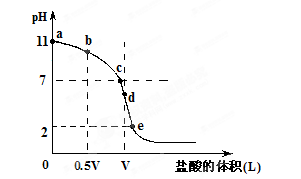 ?
?
(1)氨水的电离方程式为??????????????????????????????,该温度时氨水的电离平衡常数K=???????????????????。
(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为???????????????。
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有?????????。
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式)??????????????。
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-)
B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=?????????????,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为?????????????????。
5、选择题 已知ROH为强碱,HM为弱酸,使其完全反应后的RM溶液中,各种离子浓度由小到大的顺序是()
A.c(OH-)<c(H+)<c(M-)<c(R+)
B.c(H+)<c(M-)<c(R+)<c(OH-)
C.c(H+)<c(OH-)<c(M-)<c(R+)
D.c(R+)<c(M-)<c(H+)<c(OH-)