时间:2017-01-19 10:57:29
1、选择题 下列溶液中,常温下可以用铁罐装运的是?
A.浓盐酸
B.稀硫酸
C.浓硝酸
D.硫酸铜溶液
参考答案:C
本题解析:
试题分析:浓盐酸、稀硫酸、硫酸铜都可以与Fe发生化学反应而导致铁罐被腐蚀,不能用铁罐来装运。???但是Fe在常温下遇到浓硝酸 时被硝酸氧化产生一薄层致密的氧化物保护膜而阻止了内层的金属继续被氧化,从而起到了保护作用。因此常温下可以用铁罐装运的是浓硝酸。选项为C。
本题难度:简单
2、选择题 向一定量的Fe、FeO和Fe2O3的混合物中加入140 mL5mol/L的稀硝酸,恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为???????? ( )
A.0.24 mol
B.0.21 mol
C.0.25 mol
D.0.14 mol
参考答案:C
本题解析:
无正确答案
n(Fe2+)=[n(HNO3)―n(NO)]÷2="[0.140" L×5mol/L―2.24 L÷22.4L/mol]÷2=0.25mol
本题难度:一般
3、填空题 (9分)按要求写出下列反应的化学方程式或离子方程式
(1)钢铁工业是国家工业的基础。请回答:
①写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:???????????????????
②在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。
写出铁粉和水蒸气反应的化学方程式:?????????????????????????????????????
(2)铝片放入NaOH溶液中有气体生成,写出反应的离子方程式:??????????????????????
参考答案:本题解析:略
本题难度:一般
4、选择题 有一铁的氧化物样品,用5 mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标况下0.56L Cl2,使亚铁离子全部变成Fe3+,则该氧化物可能的化学式为
A.Fe2O3
B.Fe3O4
C.Fe4O3
D.Fe5O7
参考答案:D
本题解析:盐酸的物质的量是0.7mol,则氧化物中氧原子的物质的量是0.35mol。氯气是0.025mol,所以最终溶液中氯化铁的物质的量是(0.70mol+0.025mol×2)÷3=0.25mol,即铁原子的物质的量是0.25mol,所以铁原子和氧原子的物质的量之比是5︰7,所以答案选D。
本题难度:一般
5、填空题 (16分)辉铜矿是冶炼铜的重要原料。
(1)工业上冶炼粗铜的某种反应为:Cu2S+O2=2Cu+SO2
①当产生标况下11.2L气体时,转移电子数目为?????;
②将粗铜进行电解精炼,粗铜应与外电源的????????????极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为???????????;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜: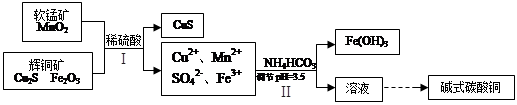
①铜单质放置于潮湿空气中,容易生成碱式碳酸铜,反应化学方程式是??????????????;
②步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为???????????????????????????????;
③步骤Ⅰ中发生如下3个反应,已知反应i)中生成的硫酸铁起催化作用。请写出反应iii)的化学方程式。
i)Fe2O3+3H2SO4 =Fe2(SO4)3+3H2O
ii) Cu2S+ Fe2(SO4)3 =CuSO4+CuS+2FeSO4
iii)??????????????????????????????????????????????
④步骤Ⅱ中调节pH后的溶液中,铜离子浓度最大不能超过???????mol/L。
(已知Ksp[(Cu(OH)2)]=2×10-a)
参考答案:(1)3NA??(2)正 ③本题解析:
试题分析:(1)①根据反应Cu2S+O2=2Cu+SO2可知,反应中氧元素化合价和铜元素化合价降低,只有硫元素的化合价从-2价升高到+4价,失去6个电子,所以当产生标况下11.2L气体即0.5mol二氧化硫时,转移电子物质的量是0.5mol×6=3mol,其数目为3NA。
②将粗铜进行电解精炼,粗铜应与外电源的正极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,增加的质量即为析出的铜,电解质溶液增重bg,设参加反应的锌和铜的质量分别是mg、ng,则m+n-a=b,根据电子守
本题难度:一般