时间:2017-01-19 10:56:30
1、选择题 下列化合物中,含有非极性键的离子化合物是
A.Ba(OH)2
B.H2SO4
C.Na2O2
D.CaCl2
参考答案:C
本题解析:试题分析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间
容易形成共价键。又因为含有离子键的化合物是离子化合物,全部由共价键形成的化合物是共价化合物,据此可知A是含有离子键和极性键的离子化合物,B是含有极性键的共价化合物,C是含有离子键和非极性键的离子化合物,D是含有离子键的离子化合物,答案选C。
考点:考查化学键以及化合物的判断
点评:该题是中等难度的试题,也是高考中的常见题型。试题基础性强,侧重对学生基础知识的巩固和检验。该题的关键是明确化学键以及化学键与化合物的关系,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力,提高学生的学习效率。
本题难度:困难
2、选择题 等物质的量的氢气和氦气具有相同的
A.质量
B.原子数
C.质子数
D.体积
参考答案:C
本题解析:设H2和He的物质的量各为1mol,则A错,1molH2的质量为2g,1molHe的质量为4g;B错,1molH2的原子数为2NA,1molHe的原子数为NA;C正确,1molH2的质子数为2NA,1molHe的质子数为2NA;D错,相同条件下两气体体积相同;
本题难度:一般
3、选择题 标准状况下有以下四种气体:①6.72L CH4②3.01×1023 HCl分子③13.6g H2S ④0.2mol NH3。下列对四种气体的关系从小到大表示不正确的是
A.物质的量:④<①<②<③
B.体积:④<①<③<②
C.质量:④<①<③<②
D.氢原子个数:②<④<③<①
参考答案:A
本题解析:①中甲烷物质的量为6.72L÷22.4L/mol=0.3mol,质量是0.3mol×16g/mol=4.8g,氢原子的物质的量是0.3mol×4=1.2mol。②HCl的物质的量是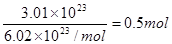 ,质量是0.5mol×36.5g/mol=18.25g,氢原子多的物质的量是0.5mol。③中H2S的物质的量是13.6g÷34g/mol=0.4mol,氢原子的物质的量是0.4mol×2=0.8mol。④中氨气的质量是0.2mol×17g/mol=3.4g,氢原子的物质的量是0.2mol×2=0.4mol。因为体积之比是物质的量之比,所以只有选项A是正确的,答案选A。
,质量是0.5mol×36.5g/mol=18.25g,氢原子多的物质的量是0.5mol。③中H2S的物质的量是13.6g÷34g/mol=0.4mol,氢原子的物质的量是0.4mol×2=0.8mol。④中氨气的质量是0.2mol×17g/mol=3.4g,氢原子的物质的量是0.2mol×2=0.4mol。因为体积之比是物质的量之比,所以只有选项A是正确的,答案选A。
本题难度:一般
4、选择题 2 mol甲烷在光照条件下与氯气完全反应,反应完成后,测得四种取代产物物质的量相等,则消耗氯气的物质的量是
A.1 mol
B.2.5 mol
C.5 mol
D.10 mol
参考答案:C
本题解析:掌握产生等物质的量的取代产物的计算.
本题难度:简单
5、选择题 现将20%的H2SO4溶液与30%的H2SO4溶液等体积混合,所得溶液的质量分数为n,则n值
A.等于25%
B.大于25%
C.小于25%
D.无法确定大小
参考答案:B
本题解析:设20%H2SO4溶液的密度为ρ1g·cm-3,30%H2SO4溶液的密度为ρ2g·cm-3,各取V mL混合,则有下面关系:
n=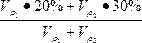
n=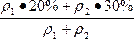
当ρ1=ρ2时,n=25%
当ρ1<ρ2时,n>25%
当ρ1>ρ2时,n<25%
H2SO4溶液浓度越大,密度越大,ρ1<ρ2,故n>25%。
具体推导可用以下方法:
方法一
n-25%=-25%=

因为ρ2>ρ1,所以上式大于0,即n>25%。
方法二
n==
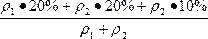 =20%+
=20%+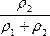 ·10%
·10%
因为ρ2>ρ1,所以>
 ,
,·10%>5%,即n>25%。
本题难度:简单