时间:2017-01-19 10:37:59
1、选择题 将足量的AgI分别放入下列物质中,AgI的溶解度由大到小的排列顺序是(???)
①5mL0.001mol·L-1KI溶液?②15mL0.002mol·L-1CaI2溶液?
③35mL0.003mol·L-1HI溶液??④15mL蒸馏水?⑤45mL0.005mol·L-1AgNO3溶液
A.①>②>③>④>⑤
B.④>①>③>②>⑤
C.⑤>④>②>①>③
D.④>③>⑤>②>①
参考答案:B
本题解析:根据碘化银的溶解平衡可知,只有降低银离子或碘离子的浓度,才能促进碘化银的溶解。①~⑤中碘离子或银离子的浓度分别为(mol/L)0.001、0.004、0.003、0、0.005,所以答案B是正确的。答案选B。
本题难度:一般
2、实验题 (15分)水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、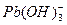 、
、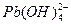 ,各形态的浓度分数α随溶液pH变化的关系如下图所示:
,各形态的浓度分数α随溶液pH变化的关系如下图所示: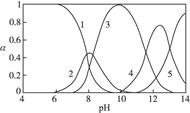
1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示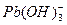 ,5表示
,5表示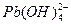
(1)Pb(NO3)2溶液中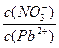 ___________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
___________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, 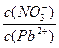 增大,可能的原因是_____________。
增大,可能的原因是_____________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有___________,pH=9时主要反应的离子方程式为______________。
参考答案:(1)>? Pb2+与Cl-发生反应,使c(Pb2+)减小<
本题解析:
(1)因为Pb(NO3)2是一种强酸弱碱盐,在水溶液中存在如下水解平衡:2H2O+Pb2+ Pb(OH)2+2H+,使c(Pb2+)减小,所以
Pb(OH)2+2H+,使c(Pb2+)减小,所以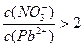 本题难度:简单
本题难度:简单
3、选择题 在常温时的下列溶液中,BaSO4的溶解度最大的是[???? ]
A.40 mL 1 mol/L的BaCl2溶液
B.30 mL 2 mol/L的Ba(OH)2溶液
C.10 mL纯水
D.50 mL 0.1 mol/L的H2SO4溶液
参考答案:C
本题解析:
本题难度:简单
4、选择题 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=CuCO3↓(几乎不发生反应。下同)
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是(??)
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
参考答案:A
本题解析:先根据第一个反应对比Cu(OH)2与CuCO3溶解度的相对大小;再根据第二个反应对比Cu(OH)2和CuS溶解度的相对大小,最后综合比较。
本题难度:一般
5、填空题 (9分)盐酸常用于清除金属表面的铜锈铁锈。某同学欲将除锈后的盐酸中的金属元素分步沉淀,查资料获知常温下水溶液中各离子沉淀的pH范围:
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 0 | 3. 0 |
| Fe2+ | 5. 8 | 8. 8 |
| Cu2+ | 4.2 | 6.7 (1)若以离子浓度降至1×10-5 mol·L-1为沉淀完全,根据上表数据推算出ksp[Fe(OH)3]= (2)根据上述数据该同学设计了以下实验流程:  A可能是 ;试剂B的化学式是 ;沉淀②化学式是 。 参考答案:(共9分):(1)1.0×10-38(3分) 本题解析: 本题难度:困难 |